
| A£® | ČōijĪĀ¶ČĻĀ£¬·“Ó¦ŗó$\frac{c£ØC{l}^{-}£©}{c£ØCl{O}^{-}£©}$=11£¬ŌņČÜŅŗÖŠ$\frac{c£ØCl{O}^{-}£©}{c£ØCl{O}_{3}^{-}£©}$=$\frac{1}{2}$ | |
| B£® | ²Ī¼Ó·“Ó¦µÄĀČĘųµÄĪļÖŹµÄĮæµČÓŚ$\frac{1}{2}$ a mol | |
| C£® | øıäĪĀ¶Č£¬·“Ó¦ÖŠ×ŖŅʵē×ÓµÄĪļÖŹµÄĮæneµÄ·¶Ī§£ŗ$\frac{1}{2}$ a mol”Üne”Ü$\frac{5}{6}$ a mol | |
| D£® | øıäĪĀ¶Č£¬²śĪļÖŠKClO3µÄ×ī“óĄķĀŪ²śĮæĪŖ$\frac{1}{7}$a mol |
·ÖĪö A£®Įīn£ØClO-£©=1mol£¬Ōņn£ØCl-£©=11mol£¬øł¾Żµē×Ó×ŖŅĘŹŲŗć¼ĘĖćn£ØClO3-£©£»
B£®ÓÉClŌ×ÓŹŲŗćæÉÖŖ£¬2n£ØCl2£©=n£ØKCl£©+n£ØKClO£©+n£ØKClO3£©£¬ÓɼŲĄė×ÓŹŲŗćæÉÖŖn£ØKCl£©+n£ØKClO£©+n£ØKClO3£©=n£ØKOH£©£¬ĮŖĮ¢¼ĘĖć²Ī¼Ó·“Ó¦ĀČĘųµÄĪļÖŹµÄĮ棻
C£®Ńõ»Æ²śĪļÖ»ÓŠKClO3Ź±£¬×ŖŅʵē×Ó×ī¶ą£¬øł¾Żµē×Ó×ŖŅĘŹŲŗćn£ØKCl£©=5£ØKClO3£©£¬ÓɼŲĄė×ÓŹŲŗć£ŗn£ØKCl£©+n£ØKClO3£©=n£ØKOH£©£¬Ńõ»Æ²śĪļÖ»ÓŠKClOŹ±£¬×ŖŅʵē×Ó×īÉŁ£¬øł¾Żµē×Ó×ŖŅĘŹŲŗćn£ØKCl£©=n£ØKClO£©£¬øł¾Ż¼ŲĄė×ÓŹŲŗć£ŗn£ØKCl£©+n£ØKClO£©=n£ØKOH£©£¬½ų¶ų¼ĘĖć×ŖŅʵē×ÓĪļÖŹµÄĮæ·¶Ī§£»
D£®Ńõ»Æ²śĪļÖ»ÓŠKClO3Ź±£¬ĘäĪļÖŹµÄĮæ×ī“ó£¬ÓɼŲĄė×ÓŹŲŗć£ŗn£ØKCl£©+n£ØKClO3£©=n£ØKOH£©£¬½įŗĻµē×Ó×ŖŅĘŹŲŗć¼ĘĖć£®
½ā“š ½ā£ŗA£®Įīn£ØClO-£©=1mol£¬·“Ó¦ŗóC£ØCl-£©£ŗC£ØClO-£©=11£¬Ōņn£ØCl-£©=11mol£¬µē×Ó×ŖŅĘŹŲŗć£¬5”Įn£ØClO3-£©+1”Įn£ØClO-£©=1”Įn£ØCl-£©£¬¼“5”Įn£ØClO3-£©+1”Į1mol=1”Į11mol£¬½āµĆn£ØClO3-£©=2mol£¬¹ŹČÜŅŗÖŠ$\frac{c£ØCl{O}^{-}£©}{c£ØCl{O}_{3}^{-}£©}$=$\frac{1}{2}$£¬¹ŹAÕżČ·£»
B£®ÓÉClŌ×ÓŹŲŗćæÉÖŖ£¬2n£ØCl2£©=n£ØKCl£©+n£ØKClO£©+n£ØKClO3£©£¬ÓɼŲĄė×ÓŹŲŗćæÉÖŖn£ØKCl£©+n£ØKClO£©+n£ØKClO3£©=n£ØKOH£©£¬¹Ź²Ī¼Ó·“Ó¦µÄĀČĘųµÄĪļÖŹµÄĮæ=$\frac{1}{2}$n£ØKOH£©=0.5amol£¬¹ŹBÕżČ·£»
C£®Ńõ»Æ²śĪļÖ»ÓŠKClO3Ź±£¬×ŖŅʵē×Ó×ī¶ą£¬øł¾Żµē×Ó×ŖŅĘŹŲŗćn£ØKCl£©=5£ØKClO3£©£¬ÓɼŲĄė×ÓŹŲŗć£ŗn£ØKCl£©+n£ØKClO3£©=n£ØKOH£©£¬¹Źn£ØKClO3£©=$\frac{1}{6}$n£ØKOH£©=$\frac{1}{6}$a mol£¬×ŖŅʵē×Ó×ī“óĪļÖŹµÄĮæĪŖ£ŗ$\frac{1}{6}$a mol”Į5=$\frac{5}{6}$a mol£¬Ńõ»Æ²śĪļÖ»ÓŠKClOŹ±£¬×ŖŅʵē×Ó×īÉŁ£¬øł¾Żµē×Ó×ŖŅĘŹŲŗćn£ØKCl£©=n£ØKClO£©£¬øł¾Ż¼ŲĄė×ÓŹŲŗć£ŗn£ØKCl£©+n£ØKClO£©=n£ØKOH£©£¬¹Ź£ŗn£ØKClO£©=$\frac{1}{2}$n£ØKOH£©=$\frac{1}{2}$a mol£¬×ŖŅʵē×Ó×īŠ”ĪļÖŹµÄĮæ=$\frac{1}{2}$a mol”Į1=$\frac{1}{2}$a mol£¬Ōņ·“Ó¦ÖŠ×ŖŅʵē×ÓµÄĪļÖŹµÄĮæneµÄ·¶Ī§ĪŖ£ŗ$\frac{1}{2}$a mol”Üne”Ü$\frac{5}{6}$a mol£¬¹ŹCÕżČ·£»
D£®Ńõ»Æ²śĪļÖ»ÓŠKClO3Ź±£¬ĘäĪļÖŹµÄĮæ×ī“ó£¬øł¾Żµē×Ó×ŖŅĘŹŲŗćn£ØKCl£©=5£ØKClO3£©£¬ÓɼŲĄė×ÓŹŲŗć£ŗn£ØKCl£©+n£ØKClO3£©=n£ØKOH£©£¬¹Źn×ī“ó£ØKClO3£©=$\frac{1}{6}$n£ØKOH£©=$\frac{1}{6}$a mol£¬¹ŹD“ķĪó£¬
¹ŹŃ”£ŗD£®
µćĘĄ ±¾Ģāæ¼²éŃõ»Æ»¹Ō·“Ó¦¼ĘĖć£¬ÄѶČÖŠµČ£¬×¢Ņāµē×Ó×ŖŅĘŹŲŗć¼°¼«ĻŽ·ØµÄÓ¦ÓĆ£¬²ąÖŲæ¼²éѧɜ¶Ō»ł“”ÖŖŹ¶µÄÓ¦ÓĆÄÜĮ¦ŗĶ·ÖĪö”¢¼ĘĖćÄÜĮ¦£®



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | 39K+ŗĶ40Ca2+Ī¢Į£ÖŠµÄµē×ÓŹżŗĶÖŠ×ÓŹż¶¼ĻąµČ | |
| B£® | D2ŗĶHeŌŚĶ¬ĪĀĶ¬Ń¹Ź±£¬ČōĢå»żĻąµČ£¬ŌņÖŹĮæĻąµČ | |
| C£® | Ķ¬Ņ»ŌŖĖŲµÄø÷ÖÖĶ¬Ī»ĖŲµÄĪļĄķŠŌÖŹ”¢»ÆѧŠŌÖŹ¾ł²»ĻąĶ¬ | |
| D£® | Į½øöÖŹĮæŹżŗĶµē×ÓŹż¶¼ĻąµČµÄĪ¢Į£²»Ņ»¶ØŹĒĶ¬ÖÖŌŖĖŲ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
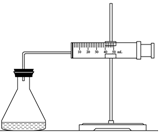 ŹµŃéŹŅÓĆH2O2·Ö½ā·“Ó¦ÖĘČ”ŃõĘųŹ±£¬³£¼ÓČė“߻ƼĮŅŌ¼Óæģ·“Ó¦ĖŁĀŹ£¬Ä³ŃŠ¾æŠŌѧĻ°Š”×éĪŖŃŠ¾æ“߻ƼĮFeCl3µÄĮæ¶ŌO2Éś³ÉĖŁĀŹµÄÓ°Ļģ£¬Éč¼ĘĮĖČēĻĀČż×鏵Ńé·½°ø£Ø¼ūĻĀ±ķ£©£¬½«±ķÖŠĖłøųµÄŹŌ¼Į°“Ņ»¶ØĢå»ż»ģŗĻŗó½ųŠŠ·“Ó¦£®
ŹµŃéŹŅÓĆH2O2·Ö½ā·“Ó¦ÖĘČ”ŃõĘųŹ±£¬³£¼ÓČė“߻ƼĮŅŌ¼Óæģ·“Ó¦ĖŁĀŹ£¬Ä³ŃŠ¾æŠŌѧĻ°Š”×éĪŖŃŠ¾æ“߻ƼĮFeCl3µÄĮæ¶ŌO2Éś³ÉĖŁĀŹµÄÓ°Ļģ£¬Éč¼ĘĮĖČēĻĀČż×鏵Ńé·½°ø£Ø¼ūĻĀ±ķ£©£¬½«±ķÖŠĖłøųµÄŹŌ¼Į°“Ņ»¶ØĢå»ż»ģŗĻŗó½ųŠŠ·“Ó¦£®| ŹµŃ鱹ŗÅ ŹŌ¼Į | A | B | C |
| 10% H2O2/mL | 20.0 | V1 | V2 |
| 2mol/L FeCl3/mL | 0 | 5.0 | 10.0 |
| H2O/mL | V3 | V4 | 0 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ĒāŃõøłĄė×ӵĵē×ÓŹ½ŹĒ£ŗ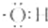 | B£® | ¼×Ķé·Ö×ӵıȥżÄ£ŠĶŹĒ£ŗ | ||
| C£® | Ļõ»łµÄ±ķŹ¾·½·Ø-NO2 | D£® | ±„ŗĶĢžµÄĶØŹ½ŹĒCnH2n+2£Øn”Ż1£© |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
 £®
£®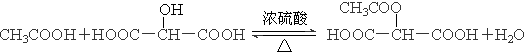 £®
£®
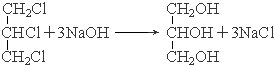 £®
£®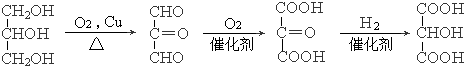 £®
£®²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ·¢Éś×°ÖĆÓėĀČĖį¼ŲÖĘČ”ŃõĘųĻąĶ¬ | |
| B£® | æÉŅŌÓĆ¼īŹÆ»ŅøÉŌļ°±Ęų | |
| C£® | ĆŽ»ØµÄ×÷ÓĆŗĶøßĆĢĖį¼ŲÖĘČ”ŃõĘųŅ»Ńł | |
| D£® | °±ĘųŃéĀśµÄ·½·ØŹĒ½«ŹŖČóµÄŗģÉ«ŹÆČļŹŌÖ½·ÅÓŚ¼ÆĘųĘæø½½ü |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | “óĄķŹÆÓėŃĪĖį·“Ó¦£ŗCO32-+2H+=H2O+CO2”ü | |
| B£® | ĻņNH4HCO3ČÜŅŗÖŠ¼Ó¹żĮæµÄNaOHČÜŅŗ²¢¼ÓČČ£ŗNH4++OH-$\frac{\underline{\;\;”÷\;\;}}{\;}$NH3”ü+H2O | |
| C£® | ½«¹żĮæSO2ĶØČėĄä°±Ė®ÖŠ£ŗSO2+NH3•H2O=HSO3-+NH4+ | |
| D£® | ÓĆĻ”ĻõĖįĻ“µÓŹŌ¹ÜÄŚ±ŚµÄŅų¾µ£ŗAg+2H++NO3-=Ag++NO”ü+H2O |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ±½µÄĻõ»Æ·“Ó¦ÖŠ£¬ĻņÅØĮņĖįÖŠ¼ÓÅØĻõĖįÖʵƻģŗĻĖį | |
| B£® | ĻņĻ”°±Ė®ÖŠÖš½„¼ÓČėĻõĖįŅųČÜŅŗĄ“ÅäÖĘŅų°±ČÜŅŗ | |
| C£® | ĻņĻą¶Ō¹żĮæµÄĒāŃõ»ÆÄĘČÜŅŗÖŠµĪČėÉŁĮæĮņĖįĶČÜŅŗŅŌÅäÖĘŠĀÖĘĒāŃõ»ÆĶ | |
| D£® | äåŅŅĶéŌŚĒāŃõ»ÆÄĘČÜŅŗµÄ“ęŌŚĻĀ½ųŠŠĖ®½āŗ󣬼ÓČėĻõĖįŅųČÜŅŗ£¬æɼģŃéäåĄė×ӵēęŌŚ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ¶ąŃ”Ģā
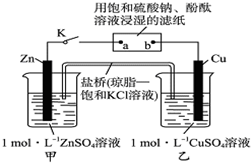
| A£® | µē×ÓŃŲZn”śa”śb”śCuĀ·¾¶Į÷¶Æ | B£® | Cuµē¼«ÉĻ·¢ÉśŃõ»Æ·“Ó¦ | ||
| C£® | ʬæĢŗóæɹŪ²ģµ½ĀĖÖ½aµć±äŗģÉ« | D£® | ʬæĢŗó¼×³ŲÖŠc£ØSO42-£©Ōö“ó |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com