
分析 (1)弱离子的水解对水的电离起促进作用,酸碱对水的电离起抑制作用,氢离子和氢氧根离子浓度越大对水的电离抑制程度越大;
(2)③醋酸、⑥NaOH溶液混合,溶液呈中性,依据醋酸是弱酸分析,同体积溶液混合溶液呈碱性,若溶液呈中性需要酸稍过量;依据溶液中电荷守恒比较氯离子浓度大小比较;
(3)将等体积的①盐酸、⑤氨水混合,溶液浓度相同,恰好反应生成氯化铵溶液,铵根离子水解显酸性;
(4)向相同体积的:①盐酸、②硫酸、③醋酸溶液中分别加入相同的且足量的锌粒,浓度均为1×10-3mol/L溶质物质的量相同,溶液中氢离子浓度②>①>③;产生氢气②>①═③;
(5)反应后的溶液相当于向醋酸中分别加入氯化钠和醋酸钠;
(6)若将等体积、等浓度的⑤氨水、⑥NaOH溶液,氨水中的溶质是弱碱存在电离平衡,溶液PH⑥>⑤;溶液加热至相同温度后,⑤溶液电离促进,氢氧根离子浓度增大,但不能完全电离;⑥溶液中离子积增大,氢氧根离子浓度不变;氢氧根离子浓度⑥>⑤.
解答 解:(1)弱离子的水解对水的电离起促进作用,酸碱对水的电离起抑制作用,所以氯化铵对水的电离起促进作用,氢离子和氢氧根离子浓度越大对水的电离抑制程度越大,硫酸是二元强酸,氢离子浓度最大,所以对水的抑制程度最大,所以水电离出的c(H+)最小,故答案为:④;②;
(2)③醋酸、⑥NaOH溶液混合,溶液呈中性,依据醋酸是弱酸分析,同体积溶液混合溶液呈碱性,若溶液呈中性需要酸稍过量③>⑥;
溶液中存在电荷守恒,C(Na+)+C(H+)=C(OH-)+C(CH3COO-)中性溶液中C(OH-)=C(H+);所以溶液中离子浓度大小关系为:C(Na+)=C(CH3COO-)>C(OH-)=C(H+),
故答案为:>;C(Na+)=C(CH3COO-)>C(OH-)=C(H+);
(3)将等体积的①盐酸、⑤氨水混合,溶液浓度相同,恰好反应生成氯化铵溶液,铵根离子水解显酸性;溶液PH<7;原因是氯化铵溶液中铵根离子水解生成一水合氨和氢离子,溶液厂酸性;离子方程式为:NH4++H2O?NH3•H2O+H+,
故答案为:<;NH4++H2O?NH3•H2O+H+;
(4)向相同体积的①、②、③溶液中分别加入相同的且足量的锌粒,c(H+)浓度决定反应速度,①②③中氢离子浓度关系为:c(硫酸)>c(盐酸)>c(醋酸),与足量的锌反应,产生H2的量决定于溶液中的n(H+),①②③中氢离子的物质的量关系为;②>①=③,
故答案是:②①③;②>①=③;
(5)向相同体积的①、③溶液中分别加入相同浓度、相同体积的CH3COONa溶液,混合后,溶液可以看成“分别向醋酸中加入等体积的①氯化钠和③醋酸钠”,由于氯化钠不影响醋酸的电离,而醋酸跟抑制了电离,故答案是:<;
(6)若将等体积的⑤、⑥溶液加热至相同温度后,由于氨水加热后挥发出氨气,氨水浓度减小,氢氧根浓度减小,pH变小,故答案是:<.
点评 本题考查较为综合,涉及溶液中离子浓度大小的比较方法,溶液中电荷守恒的应用,弱电解质电离平衡的影响因素,溶液PH的判断,酸碱反应后的溶液酸碱性的判断,侧重于学生的分析能力的考查,注意把握弱电解质的电离以及盐类水解的原理等知识,题目难度较大.


 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4L二氯甲烷的分子数约为NA个 | |
| B. | 常温常压下,2.0g重水(D2O)中含NA个电子 | |
| C. | 1.0L0.1mo1•L-1的NaHCO3溶液中含HCO3-和CO32-的离子数之和为0.1NA | |
| D. | 电解精炼铜时,若阴极得到电子数为2NA,则阳极质量减少64g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
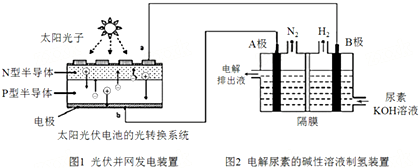
| A. | 图1中N型半导体为负极 | |
| B. | 若A极产生7.00gN2,则此时B极产生16.8L H2(标况下) | |
| C. | 电解完毕后电解液的pH增大 | |
| D. | 该系统工作时,A极的电极反应式为CO(NH2)2+8OH--6e-═CO32-+N2↑+6H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验 | 操作 | |
| A | 配制稀硫酸 | 先将浓硫酸加入烧杯中,后倒入蒸馏水 |
| B | 排水法收集KMnO4分解产生的O2 | 先熄灭酒精灯,后移除导管 |
| C | 浓盐酸与MnO2反应制备纯净Cl2 | 气体产物先通过浓硫酸,后通过饱和食盐水 |
| D | CCl4萃取碘水中的I2 | 先从分液漏斗下口放出有机层,后从上口倒出水层 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放电时,Li+在电解质中由负极向正极迁移 | |
| B. | 放电时,负极的电极反应式为LixC6-xe-═xLi++C6 | |
| C. | 充电时,若转移1mol e-,石墨(C6)电极将增重7x g | |
| D. | 充电时,阳极的电极反应式为LiCoO2-xe-═Li1-xCoO2+xLi+ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com