
甲、乙、丙、丁为四种主族元素,已知甲与乙、丙、丁三种元素相邻,甲、乙的原子序数之和等于丙的原子序数,四种元素原子的最外层电子数之和为20。下列判断中正确的
是( )
A.原子半径:丙>乙>甲
B.最外层电子数:丙=丁
C.气态氢化物的稳定性:甲>丙
D.最高价氧化物对应的水化物的酸性:丁>甲
C
【解析】由于甲、乙的原子序数之和等于丙的原子序数,且甲与乙、丙、丁相邻,故甲、乙、丁处于同一周期,丙在下一周期,则有如下两种位置关系:①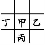 或②
或② 。若是①可设甲的原子序数为x,则乙为x+1,丁为x-1,丙为x+8,则有:x+x+1=x+8,x=7,即甲为N,乙为O,丁为C,丙为P,则四种元素原子的最外层电子数之和为20,符合题意。同理验证②不合题意。原子半径丙(P)>甲(N)>乙(O),A项错误;丙(P)最外层电子数为5,而丁(C)最外层电子数为4,B项错误;甲元素的氢化物为NH3,丙元素对应的氢化物为PH3,显然稳定性前者强,C项正确;最高价氧化物对应的水化物的酸性:HNO3>H2CO3,D项错误。
。若是①可设甲的原子序数为x,则乙为x+1,丁为x-1,丙为x+8,则有:x+x+1=x+8,x=7,即甲为N,乙为O,丁为C,丙为P,则四种元素原子的最外层电子数之和为20,符合题意。同理验证②不合题意。原子半径丙(P)>甲(N)>乙(O),A项错误;丙(P)最外层电子数为5,而丁(C)最外层电子数为4,B项错误;甲元素的氢化物为NH3,丙元素对应的氢化物为PH3,显然稳定性前者强,C项正确;最高价氧化物对应的水化物的酸性:HNO3>H2CO3,D项错误。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2014高考化学二轮专题突破 专题七化学反应与能量练习卷(解析版) 题型:选择题
化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的。如图为N2(g)和O2(g)反应生成NO(g)过程中的能量变化,下列说法正确的是( )
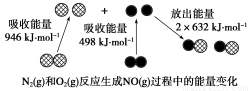
A.1 mol N2(g)和NA个O2(g)反应放出的能量为180 kJ
B.1 mol N2(g)和1 mol O2(g)具有总能量小于2 mol NO(g)具有的总能量
C.通常情况下,N2(g)和O2(g)混合能直接生成NO
D.NO是一种酸性氧化物,能与NaOH溶液反应生成盐和水
查看答案和解析>>
科目:高中化学 来源:2014高考化学专题突破训练 专题8电化学原理练习卷(解析版) 题型:选择题
下列叙述正确的是( )
A.电镀时,通常把待镀的金属制品作阳极
B.氯碱工业是电解熔融的NaCl,在阳极能得到Cl2
C.如图中电子由Zn极流向Cu,盐桥中的Cl-移向CuSO4溶液
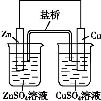
D.氢氧燃料电池(酸性电解质)中O2通入正极,电极反应为:O2+4H++4e-=2H2O
查看答案和解析>>
科目:高中化学 来源:2014高考化学专题突破训练 专题6化学反应速率和化学平衡练习卷(解析版) 题型:选择题
已知合成氨反应N2(g)+3H2(g) 2NH3(g) ΔH=-92.20 kJ·mol-1,在某温度下2 L的密闭容器中进行,测得如下数据:
2NH3(g) ΔH=-92.20 kJ·mol-1,在某温度下2 L的密闭容器中进行,测得如下数据:
时间(h) 物质的量(mol) | 0 | 1 | 2 | 3 | 4 |
N2 | 1.50 | n1 | 1.20 | n3 | n5 |
H2 | 4.50 | 4.20 | 3.60 | n4 | n6 |
NH3 | 0 | 0.20 | n2 | 1.00 | 1.00 |
下列说法正确的是( )
A.反应3 h内,反应速率v(N2)为0.17 mol·L-1·h-1
B.此温度下,该反应的平衡常数为0.037
C.反应进行到1 h时放出的热量为9.22 kJ
D.4 h时,若再加入1 mol N2,达到新的化学平衡时,N2的转化率是原来的两倍
查看答案和解析>>
科目:高中化学 来源:2014高考化学专题突破训练 专题5物质结构 元素周期律练习卷(解析版) 题型:填空题
A、B、C、D、E为原子序数依次增大的五种短周期元素,其中仅含有一种金属元素,A和D最外层电子数相同;B、C和E在周期表中相邻,且C、E同主族。B、C的最外层电子数之和等于D的原子核外电子数,A和C可形成两种常见的液态化合物。 请回答下列问题:
(1)B的原子结构示意图 。
(2)C、D、E三种原子对应的离子半径由大到小的顺序是 (填具体离子);由A、B、C三种元素按4∶2∶3组成的化合物所含的化学键类型为 。
(3)用某种废弃的金属易拉罐与A、C、D组成的化合物溶液反应,该反应的离子方程式为: 。
(4)在100 mL 18 mol/L的浓的A、C、E组成的酸溶液中加入过量的铜片,加热使之充分反应, 产生的气体在标准状况下的体积可能是 (填序号);
a.7.32 L b.6.72 L c.20.16 L d.30.24 L
若使上述反应中剩余的铜片继续溶解,可向其中加入硝酸钠,反应的离子方程式为: 。
(5)A、C两元素的单质与熔融K2CO3组成的燃料电池,其负极反应式为 ,用该电池电解1 L 1 mol/L NaCl溶液当消耗标准状况下1.12 L H2时,NaCl溶液的pH= (假设电解过程中溶液的体积不变)。
查看答案和解析>>
科目:高中化学 来源:2014高考化学专题突破训练 专题4化学反应中的能量变化练习卷(解析版) 题型:填空题
已知 0.4 mol 液态肼和足量H2O2反应生成氮气和水蒸气时放出256.64 kJ的热量。
(1)写出肼和H2O2反应的热化学方程式: 。
(2)已知H2O(l)=H2O(g) ΔH=+44 kJ/mol,则16 g液态肼与足量双氧水反应生成氮气和液态水时,放出的热量是 。
(3)上述反应应用于火箭推进器,除释放出大量热量和快速产生大量气体外,还有一个很突出的优点是 。
(4)向次氯酸钠溶液中通入一定物质的量的氨气可生成肼,写出反应的离子方程式: ,该反应的还原产物是 。
查看答案和解析>>
科目:高中化学 来源:2014高考化学专题突破训练 专题4化学反应中的能量变化练习卷(解析版) 题型:选择题
已知:①2H2(g)+O2(g) 2H2O(g)ΔH=-483.6 kJ/mol
2H2O(g)ΔH=-483.6 kJ/mol
②H2(g)+S(g)=H2S(g) ΔH=-20.1 kJ/mol。下列判断正确的是( )
A.1 mol氢气完全燃烧吸热241.8 kJ
B.1 mol H2O(g)和1 mol H2S(g)的能量相差221.7 kJ
C.由①②知,水的热稳定性小于硫化氢
D.若反应②中改用固态硫,1 mol S(s)完全反应,放出的热量小于20.1 kJ
查看答案和解析>>
科目:高中化学 来源:2014高考化学专题突破训练 专题2化学常用计量 溶液练习卷(解析版) 题型:选择题
铜既不溶于稀硫酸,也不溶于NaNO3溶液,但可溶于其混合溶液。已知某200 mL的1 mol/L硫酸溶液中含有0.6 mol/L NaNO3,理论上最多溶解Cu的质量是( )
A.19.2 g B.11.52 g C.5.76 g D.9.6 g
查看答案和解析>>
科目:高中化学 来源:2014高考化学专题突破训练 专题12化学实验基本操作与方案设计练习卷(解析版) 题型:实验题
某小组同学将一定浓度NaHCO3溶液加入到CuSO4溶液中发现生成了沉淀。甲同学认为沉淀是CuCO3;乙同学认为沉淀是CuCO3和Cu(OH)2的混合物,他们设计实验测定沉淀中CuCO3的质量分数。
(1)按照甲同学的观点,发生反应的离子方程式为 。
(2)两同学利用下图所示装置进行测定:
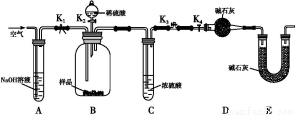
①在研究沉淀物组成前,须将沉淀从溶液中分离并净化。具体操作依次为过滤、洗涤、干燥。
②装置E中碱石灰的作用是 。
③实验过程中有以下操作步骤:
a.关闭K1、K3,打开K2、K4,充分反应
b.打开K1、K4,关闭K2、K3,通入过量空气
c.打开K1、K3,关闭K2、K4,通入过量空气
正确的顺序是 (填选项序号,下同)。若未进行步骤 ,将使测量结果偏低。
④若沉淀样品质量为m g,装置D质量增加了n g,则沉淀中CuCO3的质量分数为 。
(3)丙同学认为还可以通过测量CO2的体积并测量 来测定沉淀中CuCO3的质量分数。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com