


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、相同条件下,N2和O3的混合气体与等体积的N2所含原子数相等 |
| B、等物质的量的甲基(-CH3)与羟基(-OH)所含电子数相等 |
| C、常温常压下28 g CO与22.4 L O2所含分子数相等 |
| D、16 g CH4与18 g NH所含质子数相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、溴乙烷中滴入硝酸银溶液检验其中的溴元素:Ag++Br-=AgBr↓ | ||||
| B、14g乙烯燃烧生成液态水产生b kJ热量,则表示其燃烧热的热化学方程式为:C2H4(g)+3 O2(g)═2 H2O(g)+2 CO2(g)△H=-2 b kJ?mol-1 | ||||
C、用惰性电极电解饱和KCl溶液:2 H++2 Cl-
| ||||
| D、硫酸亚铁与双氧水、稀H2SO4混合:2 Fe2++H2O2+2 H+=2 Fe3++2 H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、稀硝酸、稀硫酸均能将木炭氧化成二氧化碳 |
| B、Na2O2与水反应、红热的Fe与水蒸气反应均生成碱 |
| C、Li、C、P分别在足量氧气中燃烧均生成一种相应氧化物 |
| D、CO2、HCl、NH3的水溶液都能导电,它们均属于电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
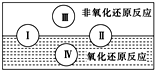 Ⅰ.已知水是人体的重要组成部分,是人体中含量最多的一种物质.而“四种基本反应类型与氧化还原反应的关系”也可用右图表达:请写出有水参加的符合反应类型Ⅳ的一个化学方程式:
Ⅰ.已知水是人体的重要组成部分,是人体中含量最多的一种物质.而“四种基本反应类型与氧化还原反应的关系”也可用右图表达:请写出有水参加的符合反应类型Ⅳ的一个化学方程式:
| ||
4- 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、所含碳原子数比为1:1 |
| B、体积比为11:7 |
| C、密度比为7:11 |
| D、分子数比为7:11 |
查看答案和解析>>
科目:高中化学 来源: 题型:
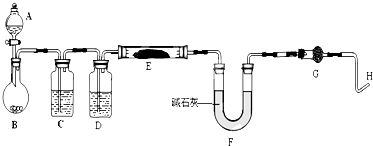
查看答案和解析>>
科目:高中化学 来源: 题型:
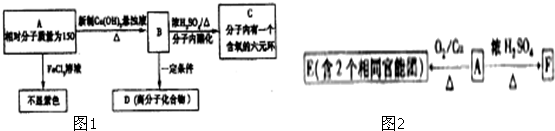
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com