
【题目】下列化合物的核磁共振氢谱中出现三组峰的是( )
A. 2,2,3,3一四甲基丁烷 B. 2,3,4一三甲基戊烷
C. 3,4一二甲基己烷 D. 2,5一二甲基己烷
 全优测试卷系列答案
全优测试卷系列答案 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案科目:高中化学 来源: 题型:
【题目】Ⅰ.在一定条件下,将1.00molN2(g)与3.00molH2(g)混合于一个10.0L密闭容器中,在不同温度下达到平衡时NH3(g)的平衡浓度如图所示.其中温度为T1时平衡混合气体中氨气的体积分数为25.0%。
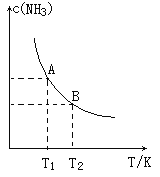
(1)当温度由T1变化到T2时,平衡常数关系K1___________K2(填“>”,“<”或“=”),焓变△H___________0.(填“>”或“<”)
(2)该反应在T1温度下5.0min达到平衡,这段时间内N2的化学反应速率为___________,N2的转化率___________;
(3)T1温度下该反应的化学平衡常数K1=___________;
(4)T1温度时,若测得高炉中c(N2)=0.5mol/L,c(H2)=0.5mol/L,c(NH3)=0.5mol/L在这种情况下,该反应是否处于平衡状态___________(填是或否),此时反应速率是v正___________v逆(填>,<,=);
Ⅱ.根据最新研究报道,在常温常压和光照条件下N2在催化剂表面与水发生反应:2N2(g)+6H2O(l)=4NH3(g)+3O2(g)。
(1)此反应的△S 0(填“>”或“<”)。
已知2CO(g)+2NO(g)=N2(g)+2CO2(g) △H="-a" kJ·mol-1
2NO(g)+O2(g)=2NO2(g) △H ="-b" kJ·mol-1;CO的燃烧热△H ="-c" kJ·mol-1。
(2)写出消除汽车尾气中NO2的污染时,NO2与CO的反应的热化学反应方程式
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏伽德罗常数的值。下列说法正确的是
A. 100mL12mol/L浓盐酸与足量MnO2共热,转移的电子数为0.6NA
B. 1mol/L的NaClO溶液中含有ClO-的数目为小于NA
C. 标准状况下,22.4L NO和11.2L O2混合后气体的分子总数为NA
D. O2和O3的混合物共3.2g,其中所含氧原子数一定为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)除去铁粉中混有的铝粉选用试剂:___________,离子方程式:___________。
(2)盛放烧碱等碱性溶液不宜用磨口玻璃塞,相应的离子方程式为:___________。
(3)用稀盐酸清洗铜器皿表面上的铜锈的方程式为___________。
(4)实验室配制好的硅酸钠溶液保存过程中变质相应化学方程式是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种含铝、锂、钴的新型电子材料,生产中产生的废料数量可观,废料中的铝以金属铝箔的形式存在;钴以Co2O3CoO的形式存在,吸附在铝箔的单面或双面;锂混杂于其中.从废料中回收氧化钴(CoO)的工艺流程如下:
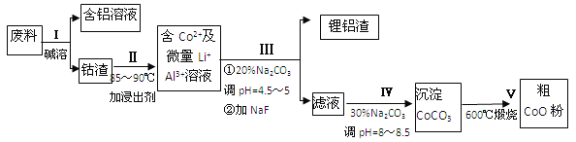
(1)过程I中采用NaOH溶液溶出废料中的Al,反应的离子方程式为 .
(2)过程II中加入稀H2SO4酸化后,再加入Na2S2O3溶液浸出钴.则浸出钴的离子反应方程式为 (产物中只有一种酸根).请从反应原理分析不用盐酸浸出钴的主要原因 .
(3)碳酸钠溶液在过程III和IV中所起作用有所不同,请分别用离子方程式表示在过程III、IV中起的作用: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前人类已发现几千万种物质,对物质进行分类,有利于我们的学习.下列物质的分类不正确的是( )
A.SO2(氧化物)
B.碘酒(单质)
C.HNO3(含氧酸)
D.氯水(混合物)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量的混合气体在密闭容器中发生反应:mA(g)+nB(g)![]() pC(g)达到平衡时,维持温度不变,将气体体积缩小到原来的1/2,当达到新的平衡时,气体C的浓度变为原平衡时的1.9倍,则下列说法正确的是( )
pC(g)达到平衡时,维持温度不变,将气体体积缩小到原来的1/2,当达到新的平衡时,气体C的浓度变为原平衡时的1.9倍,则下列说法正确的是( )
A.m+n>p B.m+n<p
C.平衡向正反应方向移动 D.C的质量分数增加
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无水MgBr2可用作催化剂。实验室采用镁屑与液溴为原料制备无水MgBr2,装置如下图所示(夹持仪器略去)。主要步骤如下:
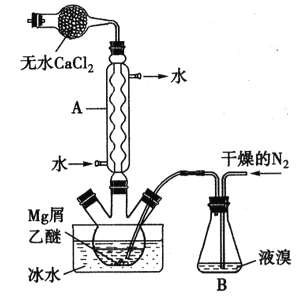
步骤l:三颈瓶中装入10g镁屑和150mL无水乙醚,装置B中加入适量的液溴。
步骤2:缓慢通入干燥的氮气,直至溴完全导入三颈瓶中。
步骤3:反应完毕后恢复至室温,过滤,将滤液转移至另一干燥的烧瓶中,冷却至0℃,析出晶体,再过滤得三乙醚合溴化镁粗品。
步骤4:常温下用苯溶解粗品,冷却至0℃,析出晶体,过滤,洗涤得三乙醚合溴化镁,加热至160℃分解得无水MgBr2产品。
已知:①Mg和Br2反应剧烈放热;MgBr2具有强吸水性。
②MgBr2+3C2H5OC2H5= MgBr2·3C2H5OC2H5
请回答:
(1)仪器A的名称是___________,它在实验中的作用是____________。
(2)步骡2中,可以将B装置中的溴完全导入三颈瓶中的原因是_______;该实验如果将所用液溴一次性全部加入三颈瓶中,其后果是_____________。
(3)步骡3中,第一次过滤得到的固体物质是______;根据步骤3、4,请总结出三乙醚合溴化镁所具有的物理性质:_________。
(4)请根据Mg的性质设计实验证明O2的氧化性比N2的强:________。
(5)将步骤得到的产品在干燥器中冷却到室温后,称量,其质量为61.4g。则该实验制取MgBr2的产率是_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com