
| 性质 | 试剂 | 化学方程式 |
| 漂白性 | ||
| 氧化性 | ||
| 还原性 | ||
| 酸性氧化物 |
分析 硫单质处于中间价态,所以硫应该既有氧化性,又有还原性,探究S的还原性,应选择S及氧化剂进行实验,氧化剂为氧气时,与S反应生化池二氧化硫;二氧化硫具有漂白性能使品红溶液褪色,二氧化硫具有氧化性可与还原剂硫化氢反应,具有还原性可与氯气反应,具有酸性氧化物的性质可与碱反应,以此来解答.
解答 解:(1)探究硫的还原性,则除S外,选择氧化剂进行实验,故答案为:氧化剂;
(2)用红热的玻璃棒引燃了石棉网上的硫粉,硫粉开始燃烧,则S与氧气反应生成二氧化硫,反应为S+O2$\frac{\underline{\;点燃\;}}{\;}$SO2,故答案为:S+O2$\frac{\underline{\;点燃\;}}{\;}$SO2;
(3)验证二氧化硫的漂白性,选择试剂为B,可观察到品红溶液褪色能说明;
验证二氧化硫的氧化剂,选择试剂为D,发生SO2+2H2S═3S↓+2H2O,观察到淡黄色沉淀生成可说明;
验证二氧化硫的还原性,选择试剂为A,发生SO2+Cl2+2H2O═H2SO4+2HCl,可观察到氯水颜色变浅,最后得到无色溶液能说明;
验证二氧化硫为酸性氧化性,选择试剂为C,发生SO2+2NaOH═Na2SO3+H2O,可观察到滴有酚酞的NaOH稀溶液由红色变为无色,可说明,
故答案为:
| 性质 | 试剂 | 化学方程式 |
| 漂白性 | B | |
| 氧化性 | D | SO2+2H2S═3S↓+2H2O |
| 还原性 | A | SO2+Cl2+2H2O═H2SO4+2HCl |
| 酸性氧化物 | C | SO2+2NaOH═Na2SO3+H2O |
点评 本题考查性质实验方案的设计,为高频考点,把握元素的化合价与物质性质的关系,验证实验中试剂选择与发生的反应为解答的关键,侧重分析与实验能力的考查,题目难度不大.


科目:高中化学 来源: 题型:选择题
| 纯净物 | 混合物 | 强电解质 | 弱电解质 | 非电解质 | |
| A | 盐酸 | 水煤气 | 硫酸 | 醋酸 | H2 |
| B | 胆矾 | 石灰水 | 硫酸钡 | H2CO3 | NH3 |
| C | 火碱 | 蔗糖溶液 | 氯化钠 | 氨水 | 三氧化硫 |
| D | 冰醋酸 | 福尔马林 | 苛性钾 | 氯化氢 | 乙醇 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
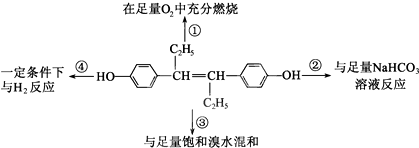
| A. | ①中生成7molH2O | B. | ②中生成2molCO2 | ||
| C. | ③最多消耗3molBr2 | D. | ④中最多消耗7molH2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 溶液中被沉淀的离子 | Fe3+ | Fe2+ | Cu2+ |
| 完全生成氢氧化物的沉淀时,溶液的pH | ≥3.7 | ≥6.4 | ≥4.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 28.4 | B. | 71g•mol-1 | C. | 28.4g•mol-1 | D. | 71 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 都属于碱性氧化物 | |
| B. | 溶于水后,所得水溶液的成分相同 | |
| C. | 都能和水发生化合反应 | |
| D. | 分别和二氧化碳反应都生成同一种盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2CO3?2H++CO32- | B. | CH3COOH=CH3COO+H+ | ||
| C. | FeCl3=Fe3++3Cl- | D. | NaHCO3=Na++H++CO32- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com