
| A. | 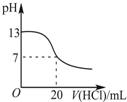 表示25℃时,用0.1mol•L-1盐酸滴定20mL 0.1mol•L-1氨水 | |
| B. | 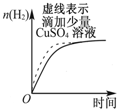 表示常温下,等量锌粉分别与两份足量的等体积等浓度的盐酸反应 | |
| C. | 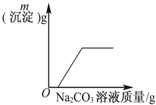 表示向CaCl2和盐酸的混合溶液中滴加Na2CO3溶液 | |
| D. |  表示向盐酸溶液中滴入氨水 |
分析 A、根据 0.1mol•L-1氨水的PH小于13来判断;
B、原电池可加快化学反应速率,氢气的质量由锌粉的质量决定;
C、CaCl2和盐酸的混合溶液中滴加Na2CO3溶液,碳酸钠首先与盐酸反应;
D、根据向盐酸溶液中滴入氨水溶液中离子浓度的变化来回答.
解答 解:A、滴定前0.1mol•L-1氨水的pH小于13,与图象不符,故A错误;
B、锌粉与硫酸铜反应生成了铜,消耗了锌粉,锌粉、铜和盐酸构成了原电池,加快了化学反应速率,但产生的氢气减少,故B错误;
C、CaCl2和盐酸的混合溶液中滴加Na2CO3溶液,碳酸钠首先与盐酸反应,所以开始没有沉淀生成,盐酸反应完全后有碳酸钙沉淀生成,故C正确;
D、向盐酸溶液中滴入氨水,生成氯化铵,溶液中离子浓度不变,恰好反应后继续滴加,溶液相当于稀释,溶液中离子浓度减小,导电性减弱,故D错误;
故选C.
点评 本题以图象的形式考查了中和滴定、化学反应的先后顺序、原电池对化学反应速率的影响等,涉及知识点较多,题目难度中等.


 阶梯计算系列答案
阶梯计算系列答案科目:高中化学 来源: 题型:解答题
 某同学欲用CCl4萃取较高浓度的碘水中的碘,操作过程可以分解为如下几步:
某同学欲用CCl4萃取较高浓度的碘水中的碘,操作过程可以分解为如下几步:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入碳酸钠溶液产生白色沉淀,再加盐酸,白色沉淀消失,不一定有Ba2+ | |
| B. | 加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42- | |
| C. | 加入稀盐酸后再加入硝酸银,产生白色沉淀,则原溶液一定有Cl- | |
| D. | 加入稀盐酸产生无色气体,原物质一定有CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
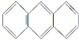 )和菲(
)和菲(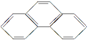 )都是比较简单的稠环芳香烃,有关它们的说法正确的是( )
)都是比较简单的稠环芳香烃,有关它们的说法正确的是( )| A. | 蒽和菲属于同系物 | |
| B. | 蒽和菲属于同分异构体 | |
| C. | 蒽的一氯代物有3种,而菲的一氯代物有5种 | |
| D. | 蒽和菲均可以看成是苯的同系物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在含FeCl2杂质的FeCl3溶液中通足量Cl2后,即可得到较纯净的FeCl3溶液 | |
| B. | 除去干燥CO2中混有的少量SO2,可将混合气体依次通过盛有酸性KMnO4溶液、浓硫酸的洗气瓶 | |
| C. |  准确量取9.50mL水 准确量取9.50mL水 | |
| D. | 1 mol 羟基中电子数为10NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | vA=0.005 mol•(L•min)-1 | B. | vC=0.025mol•(L•min)-1 | ||
| C. | vB=0.150mol•(L•min)-1 | D. | vD=0.015mol•(L•min)-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3CH2COOCH(CH3)2 | B. | CH3CH2COOCH2CH=CH2 | ||
| C. | (CH3)2CHCOOCH2CH(CH3)2 | D. | CH3CH2CH2COOCH2CH(CH3)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com