
(1)已知Na2S2O3+H2SO4===Na2SO4+S↓+SO2↑+H2O。甲同学通过测定该反应发生时溶液变浑浊的时间,研究外界条件对化学反应速率的影响。设计实验如下(所取溶液体积均为10 mL):
| 实验编号 | 实验温度/℃ | c(Na2S2O3) /mol·L-1 | c(H2SO4) /mol·L-1 |
| ① | 25 | 0.1 | 0.1 |
| ② | 25 | 0.2 | 0.1 |
| ③ | 25 | 0.1 | 0.2 |
| ④ | 50 | 0.2 | 0.1 |
| ⑤ | 50 | 0.1 | 0.1 |
其他条件不变时,探究温度对化学反应速率的影响,应选择__________(填实验编号);探究浓度对化学反应速率的影响,应选择__________(填实验编号);若同时选择①②③溶液测定变浑浊的时间,是探究__________对化学反应速率的影响。
(2)已知Na2S2O3溶液与Cl2反应时,1 mol Na2S2O3转移 8 mol 电子,该反应的离子方程式是________________________________________________________________________。
甲同学设计如下实验流程探究Na2S2O3的化学性质。
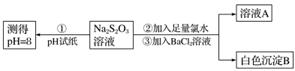
(Ⅰ)甲同学设计实验流程的目的是证明Na2S2O3溶液具有碱性和________性。
(Ⅱ)加入BaCl2溶液生成白色沉淀B的离子方程式是
________________________________________________________________________。
(Ⅲ)乙同学认为应将上述流程中②③所加试剂顺序颠倒,你认为甲、乙两同学的设计更合理的是________(填“甲”或“乙”),理由是_______________________________________。
答案 (1)①⑤或②④ ①②或①③或④⑤ 改变不同反应物的浓度
(2)S2O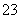 +4Cl2+5H2O===2SO
+4Cl2+5H2O===2SO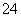 +8Cl-+10H+
+8Cl-+10H+
(Ⅰ)还原 (Ⅱ)SO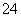 +Ba2+===BaSO4↓ (Ⅲ)乙 可以排除BaS2O3的干扰
+Ba2+===BaSO4↓ (Ⅲ)乙 可以排除BaS2O3的干扰
解析 (1)探究温度对反应速率的影响,应控制Na2S2O3、H2SO4的浓度相同,所以应选择①⑤或②④组;探究浓度对化学反应速率的影响,应控制温度相同,所以应选择①②或①③或④⑤;在①②③中,温度相同,改变的是不同反应物的浓度。
(2)由于S2O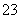 +4Cl2+5H2O===2SO
+4Cl2+5H2O===2SO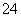 +8Cl-+10H+,所以Na2S2O
+8Cl-+10H+,所以Na2S2O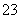 具有还原性;由于其溶液pH=8,则证明S2O
具有还原性;由于其溶液pH=8,则证明S2O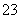 水解呈碱性;要证明S2O
水解呈碱性;要证明S2O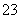 的还原性,应先加BaCl2溶液,再加足量氯水,这样可以排除BaS2O3的干扰。
的还原性,应先加BaCl2溶液,再加足量氯水,这样可以排除BaS2O3的干扰。


科目:高中化学 来源: 题型:
已知阴离子R2-的原子核内有n个中子,R原子的质量数为m,则ω g R原子完全转化为R2-时,含有电子的物质的量是 ( )
A.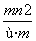 mol B.
mol B. mol
mol
C.ω(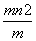 ) mol D.
) mol D.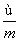 (m-n+2) mol
(m-n+2) mol
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
A.苯、油脂均不能使酸性KMnO4溶液褪色
B.乙烯和1,3丁二烯互为同系物,它们均能使溴水褪色
C.葡萄糖、果糖的分子式均为C6H12O6,二者互为同分异构体
D.乙醇、乙酸均能与Na反应放出H2,二者分子中官能团相同
查看答案和解析>>
科目:高中化学 来源: 题型:
4.6 g铜镁合金完全溶解于100 mL密度为1.40 g·mL-1、质量分数为63%的浓硝酸中,得到4 480 mL NO2和336 mL N2O4的混合气体(标准状况),向反应的溶液中加入1.0 mol·L-1 NaOH溶液至离子恰好全部沉淀时,下列说法不正确的是( )
A.该合金中铜与镁的物质的量之比是69∶46
B.该浓硝酸中HNO3的物质的量浓度是14.0 mol·L-1
C.产生沉淀8.51 g
D.离子恰好完全沉淀时,加入NaOH溶液的体积是230 mL
查看答案和解析>>
科目:高中化学 来源: 题型:
影响化学反应速率的因素很多,某课外兴趣小组用实验的方法探究影响化学反应速率的因素。
实验一:利用Cu、Fe、Mg和不同浓度的硫酸(0.5 mol·L-1、2 mol·L-1、18.4 mol·L-1),设计实验方案,研究影响反应速率的因素。
(1)甲同学的实验报告如表所示:
| 实验步骤 | 实验现象 | 实验结论 |
| ①取三份等体积的2 mol·L-1 硫酸于试管中 ②分别投入大小、形状相同的 Cu、Fe、Mg | 反应产生气泡的速率大小: Mg>Fe>Cu | 反应物的性质越活泼,反应速 率越大 |
该同学的实验目的是__________________,要想得出正确的实验结论,还需要控制的实验条件是________________________________________________________________________。
(2)乙同学为了能精确地研究浓度对反应速率的影响,在相同温度下利用如图所示装置进行定量实验。完成该实验应选用的实验药品是__________,应该测定的实验数据是________________________________________________________________________。
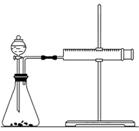
实验二:已知2KMnO4+5H2C2O4+3H2SO4===K2SO4+2MnSO4+8H2O+10CO2↑,在开始一段时间内反应速率较小,溶液褪色不明显,但反应一段时间后,溶液突然褪色,反应速率明显增大。
(3)针对上述实验现象,某同学认为该反应放热,导致溶液的温度升高,从而使反应速率增大。从影响化学反应速率的因素看,你认为还可能是________的影响。
(4)若要用实验证明你的猜想,除酸性高锰酸钾溶液、草酸溶液外,还可以在反应开始时加入________(填字母)。
A.硫酸钾 B.硫酸锰
C.氯化锰 D.水
查看答案和解析>>
科目:高中化学 来源: 题型:
如图所示,杠杆AB两端分别挂有体积相同、质量相等的空心铜球和空心铁球,调节杠杆并使其保持平衡,然后小心地向水槽中滴入浓CuSO4溶液,一段时间后,下列有关杠杆的偏向判断正确的是(实验过程中,不考虑两球的浮力变化)( )

A.杠杆为导体或绝缘体时,均为A端高B端低
B.杠杆为导体或绝缘体时,均为A端低B端高
C.当杠杆为导体时,A端低B端高
D.当杠杆为导体时,A端高B端低
查看答案和解析>>
科目:高中化学 来源: 题型:
水是人类生存和发展的宝贵资源,而水质的污染问题却越来越严重。目前,世界各国已高度重视这个问题,并积极采取措施进行治理。
(1)工业废水中常含有不同类型的污染物,可采用不同的方法处理。以下处理措施和方法都正确的是__________(填字母)。
| 选项 | 污染物 | 处理措施 | 方法类别 |
| A | 废酸 | 加生石灰中和 | 物理法 |
| B | Cu2+等重金属离子 | 加硫化物沉降 | 化学法 |
| C | 含纯碱的废水 | 加石灰水反应 | 化学法 |
(2)下图是某市污水处理的工艺流程示意图:
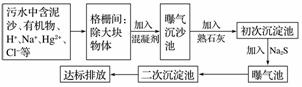
①下列物质中不可以作为混凝剂(沉降剂)使用的是____(填字母)。
A.偏铝酸钠 B.氧化铝
C.碱式氯化铝 D.氯化铁
②混凝剂除去悬浮物质的过程是________(填字母)。
A.物理变化 B.化学变化
C.既有物理变化又有化学变化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com