
| A. | Fe2+具有氧化性,维生素C具有还原性 | |
| B. | Fe2+具有氧化性,维生素C也具有氧化性 | |
| C. | Fe2+具有还原性,维生素C具有氧化性 | |
| D. | Fe2+具有还原性,维生素C也具有还原性 |
科目:高中化学 来源: 题型:解答题
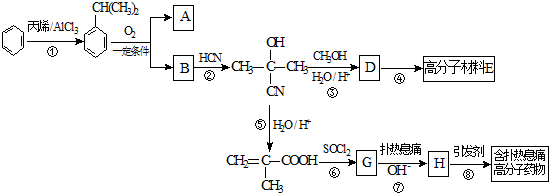
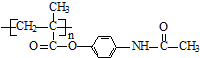 .
.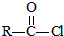
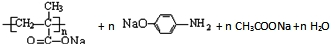
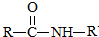 $\stackrel{NaOH溶液}{→}$RCOONa+R′-NH2
$\stackrel{NaOH溶液}{→}$RCOONa+R′-NH2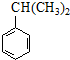 可转化为1mol A和1mol B,且A与FeCl3溶液作用显紫色,写出A的稀溶液与过量浓溴水发生反应的化学方程式
可转化为1mol A和1mol B,且A与FeCl3溶液作用显紫色,写出A的稀溶液与过量浓溴水发生反应的化学方程式 .
.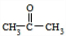 ;扑热息痛的结构简式为
;扑热息痛的结构简式为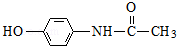 .
.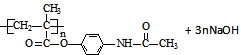 →
→ .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气与水反应:Cl2+H2O═2H++Cl-+ClO- | |
| B. | 碳酸钙溶于稀盐酸中:CO32-+2H+═H2O+CO2↑ | |
| C. | 钠与水反应:2Na+2H2O═2Na++2OH -+H2↑ | |
| D. | 硫酸铝溶液与氨水反应:Al3++3 OH -═Al(OH)3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用焦炭在电炉中还原二氧化硅制取硅单质 | |
| B. | 用煤炭作燃料发电 | |
| C. | 用铁矿石炼铁 | |
| D. | 用纯碱制玻璃 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸铝溶液加入过量氨水:Al3++3NH3•H2O═Al(OH)3↓+3NH4+ | |
| B. | 稀盐酸与碳酸钙反应:2H++CO32-═H2O+CO2↑ | |
| C. | 硅酸钠溶液与醋酸溶液混合:SiO32-+2H+═H2SiO3↓ | |
| D. | 稀硫酸中加入铁粉:2Fe+6H+═2Fe3++3H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
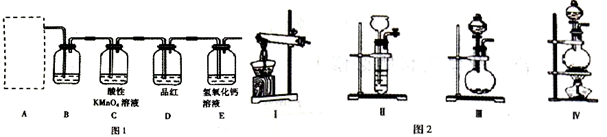
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
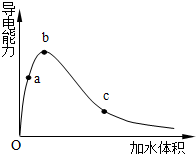 (1)某煤化工产业链的一部分发生某一反应,
(1)某煤化工产业链的一部分发生某一反应,查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (用电子式表示).
(用电子式表示).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com