
 5种固体物质A、B、C、D、E由表中不同的阴阳离子组成,它们均易溶于水.
5种固体物质A、B、C、D、E由表中不同的阴阳离子组成,它们均易溶于水.| 阳离子 | Na+ Al3+Fe3+ Cu2+、Ba2+ |
| 阴离子 | OH- Cl- CO32- NO3- SO4- |
分析 5种固体物质A、B、C、D、E由表中不同的阴阳离子组成,它们均易溶于水,由离子共存可知,一定含有:Na2CO3、Ba(OH)2,
①A溶液与C溶液混合后产生蓝色沉淀,向该沉淀中加入足量稀HNO3,沉淀部分溶解,剩余白色固体,说明生成氢氧化铜与硫酸钡,故A、C分别为Ba(OH)2、CuSO4中的一种;
②B溶液与E溶液混合后产生红褐色沉淀,同时产生大量气体,说明生成氢氧化铁与二氧化碳,应碳酸钠与铁盐发生双水解反应,B、E分别为Na2CO3、铁盐中的一种;
③少量C溶液与D溶液混合后产生白色沉淀,过量C溶液与D溶液混合后无现象,结合①可知,C为Ba(OH)2、D为铝盐,故A为CuSO4;
④B溶液与D溶液混合后无现象,结合②可知,B为铁盐,E为Na2CO3,
⑤将38.4g Cu片投入装有足量D溶液的试管中,Cu片不溶解,再滴加1.6mol•L-1稀H2SO4,Cu逐渐溶解,管口附近有红棕色气体出现,D含有NO3-,结合③可知D为Al(NO3)3,
综上所述,可知B中含有Cl-,故B为FeCl3,据此解答.
解答 解:(1)此推断A、C的化学式为CuSO4、Ba(OH)2 ,故答案为:CuSO4;Ba(OH)2;
(2)步骤②,E为Na2CO3溶液,B为FeCl3溶液,二者发生双水解反应生成氢氧化铁沉淀和二氧化碳,则其反应方程式为:2Fe3++3CO32-+3H2O=2Fe(OH)3↓+3CO2↑;
故答案为:2Fe3++3CO32-+3H2O=2Fe(OH)3↓+3CO2↑;
(3)D为Al(NO3)3溶液,铝盐溶液显酸性,因为铝离子水解生成氢离子,即 Al3++3H2O?Al(OH)3+3H+,所以向溶液中滴入石蕊试液,溶液会由无色变成红色;
故答案为:由无色变成红色; Al3++3H2O?Al(OH)3+3H+;
(4)38.4 g Cu的物质的量为:$\frac{38.4g}{64g/mol}$=0.6mol,步骤⑤中发生的离子反应方程式为:3Cu+8H++2NO3-=3Cu2++2NO+4H2O,若要将Cu片完全溶解,需要氢离子的物质的量为1.6mol,故至少加入稀H2SO4的体积设为V,即1.6mol/L×V×2=1.6mol,解V=500mL,
故答案为:500;
(5)500mL 3mol•L-1的Na2CO3溶液中的Na2CO3物质的量=0.5L×3mol/L=1.5mol,11.2L CO2的物质的量=$\frac{11.2L}{22.4L/mol}$=0.5mol,发生反应Na2CO3+CO2+H2O=2NaHCO3,由方程式可知,生成1molNaHCO3,剩余1molNa2CO3,溶液中钠离子浓度最大,碳酸氢根与碳酸根都水解,溶液呈碱性,碳酸氢根的水解程度小于碳酸根水解程度,故溶液中离子浓度:c(H+)<c(OH-)<c(CO32-)<c(HCO3-)<c(Na+),
故答案为:c(H+)<c(OH-)<c(CO32-)<c(HCO3-)<c(Na+);
(6)若用惰性电极电解CuSO4和FeCl3的混合溶液,溶质的物质的量均为0.1mol,
首先,阳极发生反应:2Cl--2e-=Cl2↑,则n(电子)=$\frac{V}{22.4}$×2=$\frac{V}{11.2}$,即V=11.2n,根据氯原子守恒可知,生成氯气的最大体积=$\frac{0.1mol×3}{2}$×22.4L/mol=3.36L,此时转移电子物质的量为0.3mol;
然后,阳极发生反应:4OH--4e-=O2↑+2H2O,则n(电子)=$\frac{V}{22.4}$×4=,即V=5.6n,
故通电后阳极产生气体的体积(标准状况下)V与通过电子的物质的量n的关系为: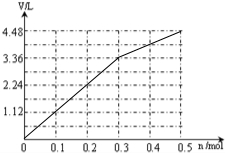 ,
,
故答案为: .
.
点评 本题考查了离子性质和离子共存的分析判断,题目综合性较强,涉及无机物推断、离子检验、盐类水解、离子浓度比较、电解原理等,需要学生熟练掌握基础知识,有利于考查学生的推理能力,难度中等.


 出彩同步大试卷系列答案
出彩同步大试卷系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
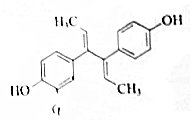 双烯雌酚是人工合成的雌激素化合物,其结构简式如图,下列说法不正确的是( )
双烯雌酚是人工合成的雌激素化合物,其结构简式如图,下列说法不正确的是( )| A. | 分子式为C18H18O2,可溶于氯仿或氢氧化钠溶液 | |
| B. | 双烯雌酚既可发生加聚反应,也可以发生缩聚反应 | |
| C. | 其苯环上的二氯代物有7种 | |
| D. | 1 mol双烯雌酚跟H2反应,最多可消耗8mol H2. |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验方案 | 现象及结论 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 容器内气体的压强不再变化时,反应一定处于平衡状态 | |
| B. | 降低c(CO)和增加C(s)均可以使平衡向正反应方向移动 | |
| C. | 其他条件一定时,升高温度和减小压强均可使CO2的转化率降低 | |
| D. | 在一定条件下,CO2的生成速率等于CO的生成速率时,反应一定处于平衡状态 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
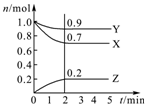 某温度时,在2L密闭容器中,三种气态物质X、Y、Z的物质的量(n)随时间(t)变化的曲线如图所示,由图中数据分析可得:
某温度时,在2L密闭容器中,三种气态物质X、Y、Z的物质的量(n)随时间(t)变化的曲线如图所示,由图中数据分析可得:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 聚丙烯的链节:-CH2CH(CH3)- | B. | 乙酸的分子式:CH3COOH | ||
| C. | 对硝基苯酚的结构简式: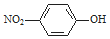 | D. | H2S的电子式: |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | D |
| 钢闸门容易被腐蚀 | a、b均为惰性电极,b极反应是:O+4OH--4e-=2H2O | 阴、阳两极生成的气体的物质的量之比是1:1 | 电池工作一段时间 后,乙池溶液的总质量增加 |
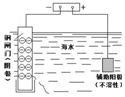 | 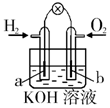 | 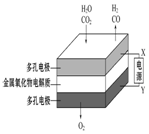 | 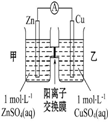 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com