
对于3Fe(s)+4H2O(g)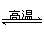
 Fe3O4(s)+4H2(g),反应的化学平衡常数的表达式为( )
Fe3O4(s)+4H2(g),反应的化学平衡常数的表达式为( )
A.K=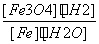 B.K=
B.K=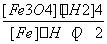
C.K=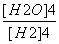 D.K=
D.K=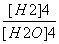
 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案科目:高中化学 来源: 题型:
在一定条件下,S8(s)和O2(g)发生反应依次转化为SO2(g)和SO3(g)。反应过程中的能量关系可用右图简单表示(图中的ΔH表示生成
1 mol产物的数据)。

(1)写出表示S8燃烧热的热化学方程式________________________________
________________________________________________________________。
(2)写出SO3分解生成SO2和O2的热化学方程式_________________________
_________________________________________________________________。
(3)若已知1个S8分子中有8个硫硫键,硫氧键的键能为d kJ·mol-1,氧氧键的键能为e kJ·mol-1,则S8分子中硫硫键的键能为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
某化学兴趣小组对电化学问题进行了实验探究。
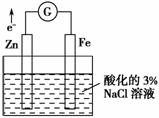
Ⅰ.利用如图所示装置探究金属的防护措施,实验现象是锌电极不断溶解,铁电极表面有气泡产生。
(1)写出负极的电极反应________
________________________________________________________________。
(2)某学生认为,铁电极可能参与反应,并对产物作出假设。
假设 1 :铁参与反应,被氧化生成Fe2+;
假设 2 :铁参与反应,被氧化生成Fe3+;
假设 3 :________________________________________________________。
(3)为了探究假设1 、2,他采取如下操作:
①取0.01 mol·L-1 FeCl3溶液 2 mL于试管中,加入过量铁粉;
②取操作①试管的上层清液加入2滴K3[Fe(CN)6]溶液,生成蓝色沉淀;
③取少量正极附近溶液加入2滴 K3[Fe(CN)6]溶液,未见蓝色沉淀生成;
④取少量正极附近溶液加入2滴 KSCN 溶液,未见溶液变红。
据②、③、④现象得出的结论是__________________ _____________________________________。
(4)该实验原理可应用于防护钢铁腐蚀,请再举一例防护钢铁腐蚀的措施:_________________________________________________________________。
Ⅱ.利用如图所示装置做电解 50 mL 0.5 mol·L-1的 CuCl2 溶液实验。

实验记录:
A.阳极上有黄绿色气体产生,该气体使湿润的淀粉碘化钾试纸先变蓝后褪色(提示:Cl2 的氧化性强于IO );
);
B.电解一段时间以后,阴极表面除吸附有铜外,还出现了少量气泡和浅蓝色固体。
(1)分析实验记录 A 中试纸颜色的变化,用离子方程式解释:①________________②______________。
(2)分析实验记录 B 中浅蓝色固体可能是_____________________________
(写化学式),试分析生成该物质的原因:________________________________
________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA为阿伏加德罗常数的值。下列叙述正确的是( )
A.1.2 g金刚石中含有的碳碳单键数为0.4NA
B.4.4 g二氧化碳中含有的共用电子对数为0.4NA
C.常温时11.2 L乙烯在氧气中完全燃烧转移的电子数为6.0NA
D.常温下0.1 mol·L-1硝酸铵溶液中,NH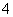 和H+总数一定大于0.1NA
和H+总数一定大于0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
能够说明一个可逆反应H2(g)+I2(g)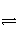
 2HI(g)已达到平衡状态的是( )
2HI(g)已达到平衡状态的是( )
A.1 mol H—H键断裂的同时有1 mol H—I键形成
B.1 mol H—H键断裂的同时有2 mol H—I键形成
C.1 mol I—I键断裂的同时有2 mol HI键形成
D.1 mol H—H键断裂的同时有1 mol I—I键形成
查看答案和解析>>
科目:高中化学 来源: 题型:
可逆反应aA(g)+bB(g)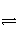
 cC(g)的正、逆反应速率可用各反应物或生成物浓度的变化来表示。下列各关系式中能说明反应已达到平衡状态的是( )
cC(g)的正、逆反应速率可用各反应物或生成物浓度的变化来表示。下列各关系式中能说明反应已达到平衡状态的是( )
A.av正(A)=bv正(B) B.bv正(A)=av逆(B)
C.av正(C)=cv正(A) D.av正(A)=bv逆(B)
查看答案和解析>>
科目:高中化学 来源: 题型:
下列对各组离子或物质是否能够大量共存解释正确的是
( )。
| A | 常温常压下NH3、O2、H2、CO2 | 不能共存 | NH3为碱性气体、CO2为酸性气体,二者反应生成(NH4)2CO3 |
| B | c(OH-)=1.0×10-13 mol·L-1溶液中,Fe2+、NO | 不能共存 | 发生反应:3Fe2++NO |
| C | 溶液中:K+、Cu2+、Cl-、NH3·H2O | 不能共存 | 发生反应:Cu2++2OH-===Cu(OH)2↓ |
| D | 溶液中:Al3+、Na+、SO | 可以共存 | 不能发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
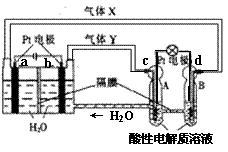
“天宫一号” RFC供电系统是一种将水电解技术与氢氧燃料电池技术相结合的可充放电池。右图为RFC工作原理示意图,有关说法正确的是
A.当转移0.1 mol电子,a极产生2.24 L H2
B.b电极反应是:4H2O +4e-=2H2↑+4OH—
C.d电极反应是:O2 +4H+ +4e-=2H2O
D.c极上发生还原反应,B中H+经隔膜进入A
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com