
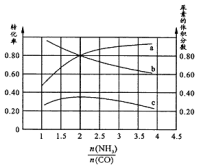
 ��CO�ϳ����صķ�ӦΪ��2NH3��g��+CO��g��?CO��NH2��2��g��+H2��g����H��0��
��CO�ϳ����صķ�ӦΪ��2NH3��g��+CO��g��?CO��NH2��2��g��+H2��g����H��0������ ��1��������CO��ת����Ϊ80%������һ����̼��ת����������V=$\frac{��C}{��t}$����V��CO����Ȼ����������֮�ȵ��ڼ���ϵ��֮�ȼ���V��NH3���������μ���ƽ��ʱ�����ʵ�Ũ�ȣ�����ƽ�ⳣ������ʽ����ƽ�ⳣ����
��A�����ݦ�=$\frac{m}{V}$�жϣ�
B�������¶ȶ�ƽ���ƶ���Ӱ���жϣ�
C����Ӧ�ﵽƽ��������������䣬��ԭ�����г���һ������������Ϊ����������䣬����ƽ�ⲻ�ƶ����ݴ��жϣ�
D������K��Ӱ�����ؽ��
��2����Ӧ�����������ϵģ�����һ�ַ�Ӧ��Ũ�ȿ��������һ�ַ�Ӧ���ת���ʣ�����ת���ʽ��ͣ���ͼ��֪��������Ϊ$\frac{n��N{H}_{3}��}{n��C{O}_{2}��}$=2ʱ�����ص���������������ת����Ϊ80%�����ݷ�ӦΪ���������С�ķ�Ӧ�����Լ�ѹ������߷�Ӧ���ʣ�ʹƽ�������ƶ���
��� �⣺��1������������һ����̼ת����Ϊ��1mol��80%=0.8mol����V��CO��=$\frac{\frac{0.8mol}{2L}}{5min}$=0.08mol?L-1?min-1������������֮�ȵ��ڼ���ϵ��֮�ȵã�V��NH3��=2V��CO��=0.16mol?L-1?min-1��
��������ã�
2NH3��g��+CO��g��?CO��NH2��2��g��+H2��g��
C0��mol/L�� 1 0.5 0 0
��C��mol/L�� 0.8 0.4 0.4 0.4
Cƽ��mol/L�� 0.2 0.1 0.4 0.4
���Է�Ӧƽ�ⳣ����K=$\frac{0.4��0.4}{0.2��0.2��0.1}$=40��
�ʴ�Ϊ��0.16mol?L-1?min-1��40��
��A����Ӧ��������ﶼ�����壬�����������������䣬����������䣬���������ܶ�Ϊ��ֵ��ʼ�ղ��䣬���������жϷ�Ӧ�Ƿ�ﵽƽ��״̬����A����
B.2NH3��g��+CO��g��?CO��NH2��2��g��+H2��g����H��0Ϊ���ȷ�Ӧ�������¶�ƽ�������ƶ������غ�����С����B����
C����Ӧ�ﵽƽ��������������䣬��ԭ�����г���һ������������Ϊ����������䣬����ƽ�ⲻ�ƶ���CO��ת���ʲ��䣬��C��ȷ��
D��Kֻ���¶�Ӱ�죬�¶Ȳ��䣬K���䣬��D��ȷ��
��ѡ��CD��
��2����Ӧ�����������ϵģ�����һ�ַ�Ӧ��Ũ�ȿ��������һ�ַ�Ӧ���ת���ʣ�����ת���ʽ��ͣ�����ͼ���֪��b����Ϊ����ת�������ߣ�
��ͼ��֪��������Ϊ$\frac{n��N{H}_{3}��}{n��C{O}_{2}��}$=2ʱ�����ص��������������ݷ�ӦΪ���������С�ķ�Ӧ�����Լ�ѹ������߷�Ӧ���ʣ�ʹƽ�������ƶ�������
���ڸ÷�Ӧ��������Ӧ�����������������������Ĵ�ʩΪ����ѹǿ��
�ʴ�Ϊ��b��2������ѹǿ��
���� ���⿼���˻�ѧ��Ӧ�������ȣ���Ҫ�漰��Ӧ���ʵļ��㡢ƽ���־��ƽ�ⳣ����ƽ�������жϼ��㣬��ȷ��ѧƽ����������ƶ�Ӱ�������ǽ���ؼ�����Ŀ�Ѷ��еȣ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �÷�Ӧ�ķ�Ӧ���������Ȳ�����������QkJ | |
| B�� | 1mol S��g����1 mol O2��g����Ӧ������1 mol SO2��g�����ų�Q kJ������ | |
| C�� | ��S��s��+O2��g���TSO2��g�� ��Ӧ�У�����1 mol SO2��g���ų�����������Q KJ | |
| D�� | 1��S��g����1��O2��g�� ��ȫ��Ӧ���Էų�Q KJ������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
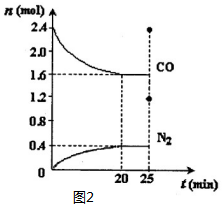 �Ժ������ʵ��о����������ż�Ϊ��Ҫ�����壮
�Ժ������ʵ��о����������ż�Ϊ��Ҫ�����壮
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� |  CO2���ռ� | B�� | 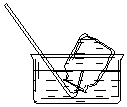 NO���ռ� | C�� | 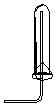 NH3���ռ� | D�� | 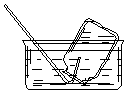 Cl2���ռ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ����Ƭ��ϡ���ᷴӦ��ȡ����ʱ������ 98%��Ũ������Լӿ�������������� | |
| B�� | 100mL2mol•L-1 �������пƬ��Ӧ�������������Ȼ�����Һ����Ӧ���ʲ��� | |
| C�� | SO2 �Ĵ�������һ�����ȵķ�Ӧ�����������¶ȣ���Ӧ���ʼ��� | |
| D�� | ����β���е� NO �� CO ���Ի�����Ӧ���� N2 �� CO2����Сѹǿ��Ӧ���ʼ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ����ϡ���ᷴӦ��Fe+2H+�TFe2++H2�� | |
| B�� | ����������Һ�����ᷴӦ��OH-+H+�TH2O | |
| C�� | п������ͭ��Һ��Ӧ��Zn+Cu2+�TZn2++Cu | |
| D�� | ����������Һ��ϡ���ᷴӦ��H++SO42-+OH-+Ba2+�TBaSO4��+H2O |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��ͬ���ʵ���Ũ�ȵ�NaA��HA�����Һ�ʼ��� | |
| B�� | ���CO2����ѹ����̼��������c ��A-����С | |
| C�� | ��̼�����ϵ�pHΪ5.0ʱ��$\frac{c��HA��}{c��{A}^{-}��}$=0.16 | |
| D�� | ̼�������и����ӵ�Ũ�ȹ�ϵΪc�� H+��=c�� HCO3-��+2c�� CO32-��+c��OH-��-c��HA�� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com