
| A. | C$\stackrel{在空气中点燃}{→}$CO$\stackrel{CuO,△}{→}$CO2$\stackrel{NaOH溶液}{→}$Na2CO3 | |
| B. | Cu$\stackrel{AgNO_{3}溶液}{→}$Cu(NO3)2溶液$\stackrel{NaOH溶液}{→}$Cu(OH)2 | |
| C. | Fe$\stackrel{点燃}{→}$Fe2O3$\stackrel{H_{2}SO_{4}溶液}{→}$Fe2(SO4)3溶液 | |
| D. | CaO$\stackrel{H_{2}O}{→}$Ca(OH)2溶液$\stackrel{Na_{2}CO_{3}}{→}$NaOH溶液 |
分析 理论上正确,要求物质的转化需符合物质的性质及变化规律;操作上可行,要求操作应简便易行;绿色化学的核心就是利用化学原理从源头上减少和消除工业生产对环境的污染.
A、一氧化碳是有毒的气体,碳在氧气中燃烧生成的进行实验时要进行尾气处理,且一氧化碳是可燃性气体,不纯时加热或点燃引起爆炸.
B、硝酸银价格较高.
C、铁在氧气中燃烧生成四氧化三铁
D、理论上正确,操作较为简便,利用碳酸钠获得氢氧化钠,经济上也合理,对环境几乎无影响,符合绿色化学.
解答 解:A、碳不完全燃烧可生成一氧化碳,一氧化碳高温下与氧化铜反应生成铜和二氧化碳,二氧化碳与氢氧化钠反应生成碳酸钠;理论上正确,反应过程中产生、利用污染环境的物质CO,不符合绿色化学,一氧化碳是有毒的气体,碳在氧气中燃烧生成的进行实验时要进行尾气处理,且一氧化碳是可燃性气体,不纯时加热或点燃引起爆炸,操作上较为复杂,故A错误;
B、铜与与硝酸银反应可生成硝酸铜,硝酸铜与氢氧化钠可生成氢氧化铜沉淀;理论上正确,操作上也较简便,但利用硝酸银、氢氧化钠制取氢氧化铜,经济上不合理,故B错误;
C、铁在氧气中燃烧生成四氧化三铁而不能生成三氧化二铁,因此该方案在理论上就是错误的,故C错误;
D、氧化钙与水反应可生成氢氧化钙,氢氧化钙与碳酸钠反应可生成氢氧化钠;理论上正确,操作也只需要加入液体较为简便,利用碳酸钠获得氢氧化钠,经济上也合理,符合绿色化学,故D正确;
故选D.
点评 本题考查实验准备方案设计与评价、绿色化学等,难度中等,是理论知识联系生活实际的体现、理论知识对实际的指导.注意实验方案设计应理论正确、操作简单可行、经济节约、绿色环保.


科目:高中化学 来源: 题型:解答题
| 温度 | 平衡浓度/(mol•L-1) | |
| c(NH3) | c(CO2) | |
| T1 | 0.1 | |
| T2 | 0.1 | |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | Y遇到氯化铁溶液时显紫色,X能使溴的四氯化碳溶液褪色 | |
| B. | X含3个手性碳原子 | |
| C. | 1mol X与足量NaOH溶液反应,最多可消耗3mol NaOH | |
| D. | 1个Y分子中最多有8个原子共面 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
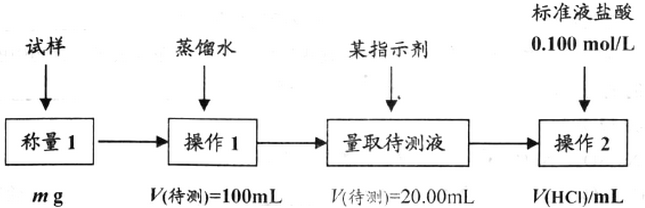
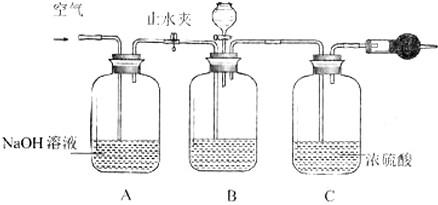
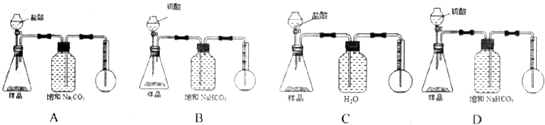
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验目的 | 主要仪器 | 试剂 |
| A | 测定中和热 | 量筒、温度计、酒精灯 | 盐酸、NaOH溶液 |
| B | 制备氢氧化铁胶体 | 烧杯、胶头滴管、酒精灯 | 饱和FeCl3溶液 |
| C | 配制10%CuSO4溶液100g | 100ml 容量瓶、玻璃棒 | 胆矾 |
| D | 实验室制取、收集干燥的氨气 | 大试管、酒精灯 | 氯化铵、消石灰、无水CaCl2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
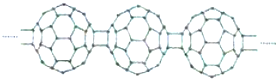
| A. | C60转变为X是物理变化 | B. | X中含积极性共价键 | ||
| C. | X与金刚石互为同位素 | D. | X能够发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若某温度下,0.2 mol/L的醋酸与0.09 mol/L的氢氧化钡等体积混合后呈中性(不考虑混合后溶液体积的变化),则可算出该温度下醋酸的电离常数 K=9×10-7 mol/L | |
| B. | 若某温度下氯化银的Ksp=10-10mol2/L2,则100 mL0.2 mol/L的氯化钠溶液与0.18 mol/L硝酸银溶液等体积混合后(不考虑混合后溶液体积的变化),溶液中c(Ag+)为10-8 mol/L | |
| C. | 若某温度下1 L密闭容器中反应HCHO(g)十H2(g)?CH3OH(g)达到平衡后甲醛的转化率为50%,则该温度下该反应的平衡常数是2(mol/L)-1 | |
| D. | 若向氢氧化钙的饱和溶液中加人氢氧化钠溶液,则会有固体析出 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

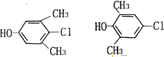 (写两种)
(写两种) 的化学方程式
的化学方程式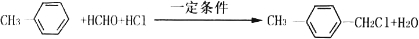 ,
,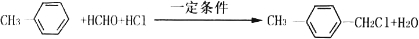 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com