


 结构,两分子A可发生酯化反应,说明A中含有-OH和-COOH,则可知A为CH3CH(OH)CH2COOH,B为
结构,两分子A可发生酯化反应,说明A中含有-OH和-COOH,则可知A为CH3CH(OH)CH2COOH,B为 ,则C为HOOCCH2COOH,E为HOOC-COOH,F中含有甲基,并且可以使溴水褪色,说明含有碳碳双键,应为CH3CH=CHCOOH,F发生加聚反应生成G,G的结构简式为
,则C为HOOCCH2COOH,E为HOOC-COOH,F中含有甲基,并且可以使溴水褪色,说明含有碳碳双键,应为CH3CH=CHCOOH,F发生加聚反应生成G,G的结构简式为 ,在浓硫酸作催化剂、加热条件下,A发生酯化反应生成H,H的结构简式为
,在浓硫酸作催化剂、加热条件下,A发生酯化反应生成H,H的结构简式为 ,结合有机物的结构和性质解答该题.
,结合有机物的结构和性质解答该题. 结构,两分子A可发生酯化反应,说明A中含有-OH和-COOH,则可知A为CH3CH(OH)CH2COOH,B为
结构,两分子A可发生酯化反应,说明A中含有-OH和-COOH,则可知A为CH3CH(OH)CH2COOH,B为 ,则C为HOOCCH2COOH,E为HOOC-COOH,F中含有甲基,并且可以使溴水褪色,说明含有碳碳双键,应为CH3CH=CHCOOH,F发生加聚反应生成G,G的结构简式为
,则C为HOOCCH2COOH,E为HOOC-COOH,F中含有甲基,并且可以使溴水褪色,说明含有碳碳双键,应为CH3CH=CHCOOH,F发生加聚反应生成G,G的结构简式为 ,在浓硫酸作催化剂、加热条件下,A发生酯化反应生成H,H的结构简式为
,在浓硫酸作催化剂、加热条件下,A发生酯化反应生成H,H的结构简式为 ,
, ,所以该反应方程式为:
,所以该反应方程式为: ,
, ;
; ,
, .
.


 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案科目:高中化学 来源: 题型:
| A、c(NH4+)>c(Cl-)>c(H+)>c(OH-) |
| B、c(Cl-)>c(NH4+)>c(OH-)>c(H+) |
| C、c(Cl-)>c(NH4+)>c(H+)>c(OH-) |
| D、c(NH4+)+c(H+)=c(Cl-)+c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 成分 | NaCl | Mg(OH)2 | CaCO3 | BaSO4 | 其他不溶物 |
| 质量分数(%) | 15~20 | 15~20 | 5~10 | 30~40 | 10~15 |


查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 W、X、Y、Z是四种常见的短周期主族元素,其原子半径随原子序数的变化如图所示.已知Y、Z的单质是空气的主要成分,W的原子半径在同周期中最小.请回答下列问题:
W、X、Y、Z是四种常见的短周期主族元素,其原子半径随原子序数的变化如图所示.已知Y、Z的单质是空气的主要成分,W的原子半径在同周期中最小.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 将一定质量的镁铝合金全部溶于100mL某浓度的盐酸中.向所得溶液中滴加5.0mol/L的NaOH溶液,生成沉淀质量与加入的NaOH溶液体积关系如图所示.则盐酸的物质的量浓度为
将一定质量的镁铝合金全部溶于100mL某浓度的盐酸中.向所得溶液中滴加5.0mol/L的NaOH溶液,生成沉淀质量与加入的NaOH溶液体积关系如图所示.则盐酸的物质的量浓度为查看答案和解析>>
科目:高中化学 来源: 题型:
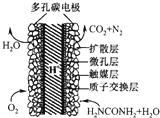 电化学化学家正在研究尿素动力燃料电池,尿液也能发电.用这种电池直接去除城市废水中的尿素,既能产生净化的水,又能发电.尿素燃料电池结构如图所示,下列关于该电池描述正确的是( )
电化学化学家正在研究尿素动力燃料电池,尿液也能发电.用这种电池直接去除城市废水中的尿素,既能产生净化的水,又能发电.尿素燃料电池结构如图所示,下列关于该电池描述正确的是( )| A、电池工作时H+移向负极 |
| B、该装置还可以将电能转化成为化学能 |
| C、电池的负极反应式为:CO(NH2)2+H2O-6e-=CO2+N2+6H+ |
| D、理论上电池工作时,每消耗67.2L O2时,可以净化2mol CO(NH2)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 实验器材和试剂 | 相应实验 |
| A | 洗气瓶(两只)、饱和Na2CO3溶液、浓硫酸 | 除去CO2中的HCl和水蒸气 |
| B | 滴定台(附滴定夹)、滴定管(酸式、碱式)、烧杯、胶头滴管 | 中和滴定实验 |
| C | 烧杯、酒精灯、火柴、胶头滴管、蒸馏水、FeCl3饱和溶液 | 制备Fe(OH)3胶体 |
| D | 铂丝或铁丝、蓝色钴玻璃、酒精灯、火柴、盐酸、待测液 | 焰色反应实验 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com