
【题目】已知A的产量是衡量一个国家石油化工生产水平的重要标志,以A为主要原料合成一种具有果香味的物质E的生产流程如下:
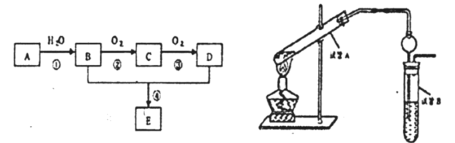
(1)有机物C的名称是_______________
(2)写出B→C的化学方程式________________
(3)请写出B+D→E的化学方程式________________
(4)试管A中加少许碎瓷片的目的是_______________
(5)试管B中试剂的作用是____________________
(6)右边试管接有一个球状物代替了长导管,其作用为______________
(7)从制备乙酸乙酯所得的混合物中分离提纯乙酸乙酯时,需要经过多步操作,下列图示的操作中,肯定需要的化学操作是_____________(填字母)

(8)酯化反应是一一可逆反应, 为提高乙醇的利用率,可采取的措施是_______________。(任写一种即可)
【答案】乙醛 2CH3CH2OH+O2![]() 2CH3CHO+2H2O CH3COOH + CH3CH2OH
2CH3CHO+2H2O CH3COOH + CH3CH2OH![]() CH3COOCH2CH3 + H2O 防止暴沸 溶解乙醇,吸收乙酸,降低乙酸乙酯的溶解度 防止溶液倒吸 a c 增加乙酸浓度、及时移走生成物(或减小生成物浓度)合理即可
CH3COOCH2CH3 + H2O 防止暴沸 溶解乙醇,吸收乙酸,降低乙酸乙酯的溶解度 防止溶液倒吸 a c 增加乙酸浓度、及时移走生成物(或减小生成物浓度)合理即可
【解析】
A的产量通常用来衡量一个国家的石油化工水平,则A为乙烯,乙烯含有碳碳双键,与水发生加成反应得到B为CH3CH2OH,B能氧化得到C为CH3CHO,C氧化得到D为CH3COOH,乙醇与乙酸发生酯化反应得到E为CH3COOCH2CH3。
(1)有机物C为CH3CHO,名称是乙醛,故答案为:乙醛;
(2)B能氧化得到C,B→C的化学方程式2CH3CH2OH+O2![]() 2CH3CHO+2H2O,故答案为:2CH3CH2OH+O2
2CH3CHO+2H2O,故答案为:2CH3CH2OH+O2![]() 2CH3CHO+2H2O;
2CH3CHO+2H2O;
(3)乙酸和乙醇在浓硫酸的催化作用下发生酯化反应,生成乙酸乙酯和水,B+D→E的化学方程式CH3COOH + CH3CH2OH![]() CH3COOCH2CH3 + H2O,故答案为:CH3COOH + CH3CH2OH
CH3COOCH2CH3 + H2O,故答案为:CH3COOH + CH3CH2OH![]() CH3COOCH2CH3 + H2O;
CH3COOCH2CH3 + H2O;
(4)试管A中加少许碎瓷片的目的是防止暴沸,故答案为:防止暴沸;
(5)由于乙酸乙酯在饱和碳酸钠溶液中的溶解度较小,碳酸钠溶液能够与乙酸反应,还能够溶解乙醇,所以通常用饱和碳酸钠溶液吸收乙酸乙酯;试管B中饱和碳酸钠溶液的作用是溶解乙醇,吸收乙酸,降低乙酸乙酯的溶解度,故答案为:溶解乙醇,吸收乙酸,降低乙酸乙酯的溶解度;
(6)吸收乙酸乙酯时需要容易发生倒吸现象,右边试管接有一个球状物代替了长导管,其作用为防止溶液倒吸,故答案为:防止溶液倒吸;
(7)从制备乙酸乙酯所得的混合物中分离提纯乙酸乙酯时,需要经过多步操作,在分液漏斗中振荡,除去乙醇和乙酸,再静置,分液,肯定需要的化学操作是a c,故答案为:a c;
(8)酯化反应是一一可逆反应, 为提高乙醇的利用率,使平衡正向移动,可采取的措施是增加乙酸浓度、及时移走生成物(或减小生成物浓度)合理即可。,故答案为:增加乙酸浓度、及时移走生成物(或减小生成物浓度)合理即可。


科目:高中化学 来源: 题型:
【题目】图为某同学设计的原电池装置
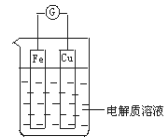
(1)当电解质溶液为稀硫酸时:
①Fe电极是_______(填“正”或“负”)极,其电极反应为_______
②Cu电极的电极反应为_________,该电极发生______反应(填“氧化”或“还原”)反应。原电池工作一段时间后,铁片的质量减少了2.8克,铜片表面产生气体____L(标准状况下),导线中通过_____mol电子。
(2)当电解质溶液为稀硝酸时:
①Fe电极是______极,其电极反应为________________,
②Cu电极是_____极,其电极反应为_________________,
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由醇X制备羧酸Z的合成路线如图所示,不正确的是( )

A. Y的结构有4种
B. X、Z能形成戊酸丁酯,戊酸丁酯最多有16种
C. 与X互为同分异构体,且不能与金属钠反应的有机物有4种
D. 与Z互为同分异构体,且能发生水解反应的有机物有9种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验装置示意图、实验现象及结论均正确的是( )
A | B | C | D | |
实验 |
|
|
|
|
现象 | 产生能使带火星小木条复燃的气体 | 两试管中均颜色变化 | 试管中有淡黄色沉淀产生 | 钠表面有气泡生成 |
结论 | FeCl3是H2O2分解的催化剂 | 单质氧化性:Cl2>Br2>I2 | 非金属性Cl>S | 1 mol乙醇与足量钠反应生成3 mol氢气 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢氧化锂(LiOH)是重要的初加工锂产品之一,可用于继续生产氟化锂、锰酸锂等,在实验室模拟用天然锂辉石(主要成分是LiAlSi2O6)生产LiOH的一种工艺流程如图所示:
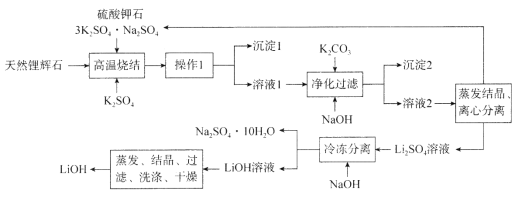
已知:溶液1中含有Li+、K+、Al3+、Na+、Fe3+、![]() 等离子。请回答下列相关问题。
等离子。请回答下列相关问题。
(1)高温烧结的目的是________________________________________________。
(2)操作1是_____________________________。
(3)判断LiOH已洗涤干净的操作是______________________________________________。
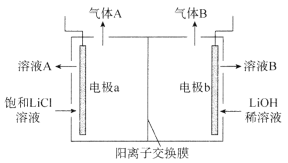
(4)工业生产中通过电解LiC1溶液的方法也可制得LiOH,其原理如图所示,电极a应连接电源的_________(选填“正极”或“负极”),电极b发生的反应是__________,阳离子交换膜的作用是_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
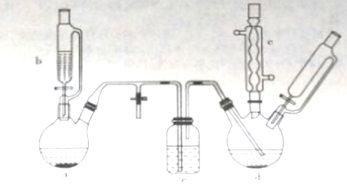
【题目】氯苯在染料、医药工业中用于制造苯酚、硝基氯苯、苯胺、硝基酚等有机中间体。实验室中制备氯苯的装置如下图所示(其中夹持仪器及加热装置略去)
请回答下列问题:
(1)仪器a中盛有KMnO4晶体,仪器b中盛有浓盐酸。打开仪器b中的活塞,使浓盐酸缓缓滴下,可观察到仪器a内的现象是__________,用离子方程式表示产生该现象的原因:_______________。
(2)仪器b外侧玻璃导管的作用是_____________。
(3)仪器d内盛有苯,FeCl3粉末固体,仪器a中生成的气体经过仪器e进入到仪器d中。
①仪器e的名称是_________,其盛装的试剂名称是_____________。
②仪器d中的反应进行过程中,保持温度在40~60℃,以减少副反应发生。仪器d的加热方式最好是___加热,其优点是____________。
(4)仪器c的作用是______________。
(5)该方法制备的氯苯中含有很多杂质,工业生产中,通过水洗除去FeCl3,HCl及部分Cl2,然后通过碱洗除去Cl2;碱洗后通过分液得到含氯苯的有机物混合物,混合物成分及沸点如下表:
有机物 | 苯 | 氯苯 | 邻二氯苯 | 间二氯苯 | 对二氯苯 |
沸点/℃ | 80 | 132.2 | 180.4 | 173.0 | 174.1 |
从该有机物混合物中提取氯苯时,采用蒸馏的方法,收集_________℃作用的馏分。
(6)实际工业生产中,苯的流失如下表:
流失项目 | 蒸气挥发 | 二氯苯 | 其他 | 合计 |
苯流失量(kg/t) | 28.8 | 14.5 | 56.7 | 100 |
某一次投产加入13t苯,则制得氯苯________t(保留一位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请分析下列各组物质,用序号填写出它们的对应关系:
①碳架异构、②官能团位置异构、③官能团类别异构、④顺反异构、⑤对映异构、⑥同一物(填序号)
(1)C2H5OH和CH3OCH3_____________________;
(2) ______________________;
______________________;
(3) __________________;
__________________;
(4) ________________________;
________________________;
(5) ____________________________;
____________________________;
(6)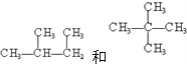 ________________________________;
________________________________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W的原子序数依次增大,它们对应的信息如下:
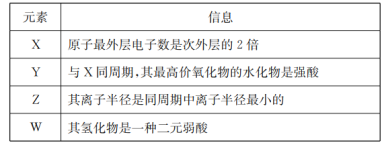
请根据表中信息填写:
(1)Z元素在周期表中的位置___________,Z的单质和氧化铁反应可用于野外焊接钢轨,该反应属于___________(填“吸热”或“放热”)反应。
(2)XW2的电子式____________。
(3)由X、Y、W三种元素按原子个数之比1:1:1组成一种分子,相对分子质量为116。已知该分子中各原子均达到8电子稳定结构,且不含双键。请写出该分子的结构式________。
(4)X、Y的最简单氢化物中,更稳定的是___________。(填化学式)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com