
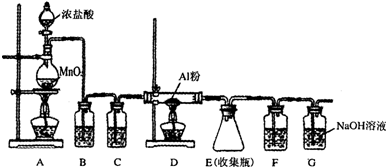
分析 根据实验装置图可知,该实验中用浓盐酸与二氧化锰反应生成氯气,氯气中有氯化氢、水等杂质,先用饱和食盐水除氯化氢,再用浓硫酸干燥,氯气与铝反应制得氯化铝,反应的尾气中有氯气用氢氧化钠吸收,为防止氯化铝与氢氧化钠溶液中的水蒸汽反应,所以在收集装置和尾气吸收装置之间加一干燥装置,
(1)实验开始时先要将装置中的空气排尽,防止空气中的水蒸汽与生成的氯化铝反应;
(2)A中发生浓盐酸和二氧化锰的反应,生成氯化锰、氯气和水;
(3)装置B是除去氯化氢气体,装置C是干燥气体,据此答题;
(4)根据所给的装置图可知,因为氯化铝易发生水解,故应该防止空气中的水蒸气进入E装置,而G是吸收空气中的CO2,所以可以加入碱石灰来代替F和G的作用;
(5)E中收集到的氯化铝粉末,打开软木塞后,氯化铝与空气中的水蒸汽发生水解反应;
(6)根据盐酸与氢氧化钠发生中和反应中用掉的氢氧化钠的物质的量可计算出残余液体中盐酸的物质的量,进而确定其浓度.
解答 解:根据实验装置图可知,该实验中用浓盐酸与二氧化锰反应生成氯气,氯气中有氯化氢、水等杂质,先用饱和食盐水除氯化氢,再用浓硫酸干燥,氯气与铝反应制得氯化铝,反应的尾气中有氯气用氢氧化钠吸收,为防止氯化铝与氢氧化钠溶液中的水蒸汽反应,所以在收集装置和尾气吸收装置之间加一干燥装置,
(1)实验开始时先要将装置中的空气排尽,防止空气中的水蒸汽与生成的氯化铝反应,所以操作依次是acbd,
故答案为:acbd;
(2)A中发生浓盐酸和二氧化锰的反应,生成氯化锰、氯气和水,反应方程式为MnO2+4HCl$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,
故答案为:MnO2+4HCl$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
(3)根据上面的分析可知,B装置中的试剂为饱和食盐水,B装置中的试剂为浓硫酸,
故答案为:饱和食盐水;浓硫酸;
(4)因为氯化铝易发生水解,故应该防止空气中的水蒸气进入E装置,而G是吸收反应剩余的氯气,所以可以加入碱石灰或氧化钙来代替F和G的作用,
故答案为:碱石灰或氧化钙;
(5)E中收集到的氯化铝粉末,打开软木塞后,氯化铝与空气中的水蒸汽发生水解反应,所以可以看到锥形瓶中有白雾产生,反应方程式为AlCl3+3H2O=Al(OH)3+3HCl,
故答案为:AlCl3+3H2O=Al(OH)3+3HCl;
(6)由题意可知,发生中和反应的氢氧化钠的物质的量为0.1000mol/L×24.00×10-3L=2.400×10-3mol,则10.00mL残余液体中盐酸的物质的量为$\frac{250}{20}$×2.400×10-3mol=3.00×10-2mol,所以残余液体中盐酸的物质的量浓度为$\frac{3.00×1{0}^{-2}}{10.00×1{0}^{-3}}$mol•L-1=3.00mol•L-1,
故答案为:3.00mol•L-1.
点评 本题考查物质的制备实验,侧重于学生的分析能力和实验能力的考查,为高考常见题型,注意把握实验的原理和注意事项,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | Na2CO3比NaHCO3易溶于水 | |
| B. | Na2CO3比NaHCO3稳定 | |
| C. | 二者在一定条件下可相互转化 | |
| D. | 与盐酸反应得到等质量CO2,用NaHCO3质量比Na2CO3要多 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaCl | B. | BaCl2 | C. | MgCl2 | D. | AlCl3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 短周期元素Q、R、T、W、Z在元素周期表中的位置如图所示,其中T是该周期离子半径最小的元素,下列说法中不正确的是( )
短周期元素Q、R、T、W、Z在元素周期表中的位置如图所示,其中T是该周期离子半径最小的元素,下列说法中不正确的是( )| A. | Q、Z、W可形成三原子直线型分子 | |
| B. | Z、R两元素气态氢化物的沸点:R>Z | |
| C. | Z、Q两元素的气态氢化物中键能大小:Z>Q | |
| D. | T、W两元素组成的化合物不能通过水溶液中的离子反应制取 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向CuSO4溶液中加入NaOH溶液得到的分散系 | |
| B. | 向水中加入食盐得到的分散系 | |
| C. | 向沸水中滴入FeCl3饱和溶液得到的红褐色液体 | |
| D. | 向澄清的石灰水中通入少量二氧化碳气体得到的分散系 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放热反应 | B. | 吸热反应 | C. | 离子反应 | D. | 不可逆反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使用脱硫煤和汽车尾气净化器,均可减少二氧化碳的排放 | |
| B. | 以治理细颗粒物(PM2.5)和可吸入颗粒物(PM10)为突破口,抓住能源效率、尾气排放和扬尘等关键环节,深入实施大气污染防治行动计划 | |
| C. | 电子垃圾统一回收、拆解、再利用,能够减少对土壤和水源的污染 | |
| D. | 加快淘汰钢铁、水泥、平板玻璃、电解铝等行业的落后产能 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com