
【题目】已知三氯化铁的熔点为306℃,沸点为315℃,易溶于水并且有强烈的吸水性,能吸收空气里的水分而潮解。某学习小组的同学对氯气与铁的反应及产物做了如下探究实验:
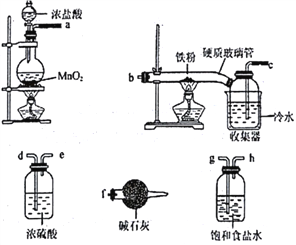
(1)装碱石灰的仪器是____________(填仪器名称),碱石灰的作用______________________。
(2)装置的连接顺序为_________________________。
(3)反应一段时间后熄灭酒精灯,冷却后将硬质玻璃管及收集器中的物质一并快速转移
至锥形瓶中,加入过量的稀盐酸和少许植物油(反应过程中不振荡),充分反应后,进行如下实验:
![]()
①固体混合物的成分是_____________________。(填化学式)
②淡黄色溶液中加入试剂X生成淡红色溶液的离子反应方程式为_______________________________。
(4)已知红色褪去的同时有气体生成,经检验为O2。该小组内的同学们对红色褪去的原因提出了三种假设。
假设I:H2O2还原Fe3+,使其转变为Fe2+;
假设Ⅱ:H2O2分解生成O2,O2氧化试剂X;
假设Ⅲ:__________________________________。(如果表达中遇到试剂X,请写出其化学式)。
并对假设进行了以下实验研究:
①取褪色后溶液三份,第一份滴加FeCl3溶液无明显变化;第二份滴加试剂X,溶液出现红色;第三份滴加稀盐酸和BaCl2溶液,产生白色沉淀。
②另取同浓度的 FeCl3溶液滴加2滴试剂X,溶液变红,再通入O2,无明显变化。 实验①说明假设__________不正确; 实验②的目的是_______________;由实验①②得出假设________是正确的。
【答案】 干燥管 吸收未反应完的氯气防止污染环境,防止空气中的水蒸汽进入收集器中使氯化铁潮解 aghdebcf Fe FeCl3 Fe3++3SCN-![]() Fe(SCN)3 H2O2氧化KSCN Ⅰ 证明假设Ⅱ不成立 Ⅲ
Fe(SCN)3 H2O2氧化KSCN Ⅰ 证明假设Ⅱ不成立 Ⅲ
【解析】本题考查实验方案设计与评价,(1)装碱石灰的仪器为干燥管或球形干燥管,根据实验目的,首先制备氯气,制备的氯气中含有HCl和水蒸气,HCl和水蒸气影响后续实验,因此必须除去,即a→g→h→d→e,得到纯净的氯气,与铁粉反应,即e→b→c,因为氯气有毒,且FeCl3易潮解,因此c→f,因此碱石灰的作用是除去未反应的氯气,以及防止空气中水蒸气进入收集器;(2)根据(1)的分析,连接顺序是aghdebcf;(3)①固体混合物中加入过量的盐酸,出现淡黄色溶液,加入试剂X,出现淡红色溶液,试剂X为KSCN,说明固体混合物中含有FeCl3,加入过量H2O2,出现深红色溶液,推出溶液中Fe3+浓度增大,即固体混合物中含有Fe,因此固体混合物成分是Fe和FeCl3;②试剂X为KSCN,加入KSCN溶液后,生成淡红色溶液,说明溶液中有Fe3+,发生的离子反应为Fe3++3SCN-![]() Fe(SCN)3 ;(4)过氧化氢具有强氧化性,可能氧化了KSCN;第一份溶液滴加FeCl3溶液,溶液不变红,说明溶液中无KSCN,第二份滴加试剂KSCN,溶液出现红色,说明溶液中含有Fe3+,因此说明假设I不正确;实验②的目的是证明假设II不成立;由上述分析,说明实验III正确。
Fe(SCN)3 ;(4)过氧化氢具有强氧化性,可能氧化了KSCN;第一份溶液滴加FeCl3溶液,溶液不变红,说明溶液中无KSCN,第二份滴加试剂KSCN,溶液出现红色,说明溶液中含有Fe3+,因此说明假设I不正确;实验②的目的是证明假设II不成立;由上述分析,说明实验III正确。


科目:高中化学 来源: 题型:
【题目】T℃,分别向10ml浓度均为1mol/L的两种弱酸HA、HB中不断加水稀释,并用pH传感器测定溶液pH。所得溶液pH的两倍(2pH)与溶液浓度的对数(1gc)的关系如图所示。下列叙述正确的是
己知:(1)HA的电离平衡常数Ka=[c(H+)·c(A-)]/[c(HA)-c(A-)]≈c2(H+)/c(HA);(2)pKa=-lgKa

A. 弱酸的Ka随溶液浓度的降低而增大
B. a点对应的溶液中c(HA)=0.1mol/L,pH=4
C. 酸性:HA<HB
D. 弱酸HB的pKa=5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子在溶液中可以大量共存,加入氢氧化钠溶液后也不产生沉淀的是( )
A.Na+、Ba2+、Cl-、SO42-B.K+、Na+、NO3-、OH-
C.H+ 、NH4+、Fe3+、SO42-D.H+、Cl-、CO32-、NO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某容器中通入V L CO2,再加入少量Na2O2后,气体体积缩小到W L,则被吸收的CO2的体积是(均为相同条件下)
A.(V—W)LB.2(V—W)LC.(2V—W)LD.2W L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】正丁醚常用作有机反应的溶剂。实验室制备正丁醚的反应和主要实验装置如下:2CH3CH2CH2CH2OH![]() (CH3CH2CH2CH2)2O+H2O,反应物和产物的相关数据如下表:
(CH3CH2CH2CH2)2O+H2O,反应物和产物的相关数据如下表:
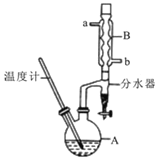

①将6 mL浓硫酸和37 g正丁醇,按一定顺序添加到A中,并加几粒沸石。
②加热A中反应液,迅速升温至135℃,维持反应一段时间。
③分离提纯:待A中液体冷却后将其缓慢倒入盛有70 mL水的温度分液漏斗中,振摇后静置,分液得粗产物。
④粗产物依次用40 mL水、20 mL NaOH溶液和40 mL水洗涤,分液后加入约3g无水氯化钙颗粒,静置一段时间后弃去氯化钙。
⑤将上述处理过的粗产物进行蒸馏,收集馏分,得纯净正丁醚11g。请回答:
(1)步骤①中浓硫酸和正丁醇的添加顺序为:应先加 。
(2)加热A前,需先从 (填“a”或“b”)口向B中通入水。
(3)步骤③的目的是初步洗去 ,振摇后静置,粗产物应 (填“上”或“下”)口倒出。
(4)步骤⑤中,加热蒸馏时应收集 (填选项字母)左右的馏分。
A.100℃ B.117℃ C.135℃ D.142℃
(5)反应过程中会观察到分水器中收集到液体物质,且分为上下两层,随着反应的进行,分水器中液体逐渐增多至充满时,上层液体会从左侧支管自动流回A。分水器中上层液体的主要成分为 ,下层液体的主要成分为 。
(6)本实验中,正丁醚的产率为 (精确到1%)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在多电子原子里,把电子运动的能量不同的区域简化为不连续的壳层称作为电子层。电子层模型被称为洋葱式结构,如图所示:
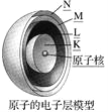
根据电子层模型,判断下列说法不正确的是( )
A. 多电子原子的核外电子是分层运动的
B. 所有电子在同一区域里运动
C. 排在K、L、M层上的电子的能量依次增大
D. 多电子原子里电子的能量不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从海水中可以获得淡水、食盐并可提取镁和溴等物质.
(1)海水淡化的方法主要有_____________、电渗析法、________________ 。
(2)必须经过化学变化才能从海水中获得的物质是(填序号)_____________.
A.氯、溴、碘 B.钠、镁、铝 C.烧碱、氢气 D.食盐、淡水
(3)从海水中提取镁的流程如图所示:
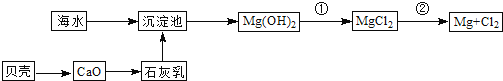
反应②的化学方程式为_________________________________________________。
(4)从海水中提取溴的主要步骤是向浓缩的海水中通入氯气,将溴离子氧化生成溴。向溴单质的水溶液中通入空气和水蒸气将溴单质吹入盛有SO2溶液的吸收塔,其目的是_________,该反应的化学方程式为________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分, 请参照元素①~⑧在表中的位置, 用化学用语回答下列问题:

(1)④、⑤、⑥的原子半径由大到小的顺序为______ ___ (填元素符号)。
(2)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是_____ (填化学式)。
(3)①、④、⑤、⑧中的某些元素可形成既含离子键又含极性共价键的化合物, 写出其中一种化合物的电子式: ______________________________。
(4)由表中两种元素的原子按1∶1组成的常见液态化合物的稀溶液易被催化分解, 可使用的催化剂为(填序号)_________________。
a.MnO2b.FeCl3c.Na2SO3d.KMnO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于钠的叙述中,错误的是( )
A.通常情况下钠是固体,密度比水的小比煤油大
B.自然界中无单质钠存在
C.钠在空气中燃烧生成过氧化钠
D.实验后剩余的少量的钠丢入废液缸中
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com