
| A. | n(HCl)<n(NH3•H2O) | B. | 盐酸过量 | C. | 恰好中和 | D. | 无法判断 |
 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入酚酞呈红色的溶液中:CO32-、NH4+、NO3-、K+ | |
| B. | 含有大量NO3-的溶液中:H+、Na+、Fe2+、Cl- | |
| C. | 强酸性溶液中:Fe3+、NH4+、Cl-、SCN- | |
| D. | 含有NaHSO4的溶液中:K+、Cu2+、Cl-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
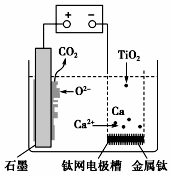 研究发现,可以用石墨作阳极、钛网作阴极、熔融的CaF2-CaO作电解质,利用图示装置获得金属钙,并以钙为还原剂还原二氧化钛制备金属钛.下列说法中错误的是( )
研究发现,可以用石墨作阳极、钛网作阴极、熔融的CaF2-CaO作电解质,利用图示装置获得金属钙,并以钙为还原剂还原二氧化钛制备金属钛.下列说法中错误的是( )| A. | 在制备金属钛前后,整套装置中CaO的总量保持不变 | |
| B. | 阳极的电极反应式为C+2O2--4e-═CO2↑ | |
| C. | 由TiO2制得1 mol金属Ti,理论上外电路通过2 mol 电子 | |
| D. | 若用铅蓄电池作供电电源,“-”接线柱应连接Pb电极 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫化钠的水解反应:S2-+H3O+?HS-+H2O | |
| B. | 室温下,氯化铵溶液显酸性的理由:NH4++H2O═NH3•H2O+H+ | |
| C. | 泡沫灭火器的反应原理:Al3++3HCO3-═3CO2↑+Al(OH)3↓ | |
| D. | 用铜作电极电解饱和食盐水:2Cl-+H2O$\frac{\underline{\;通电\;}}{\;}$Cl2↑+H2↑+2OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 190 | B. | 218 | C. | 436 | D. | 463 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
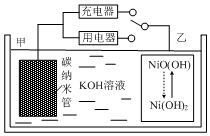 2016年8月,联合国开发计划署在中国的首个“氢经济示范城市”在江苏落户.用吸附了H2的碳纳米管等材料制作的二次电池的原理如图所示.下列说法正确的是( )
2016年8月,联合国开发计划署在中国的首个“氢经济示范城市”在江苏落户.用吸附了H2的碳纳米管等材料制作的二次电池的原理如图所示.下列说法正确的是( )| A. | 放电时,甲电极为正极,OH-移向乙电极 | |
| B. | 放电时,乙电极反应为:Ni(OH)2+OH--e-=NiO(OH)+H2O | |
| C. | 充电时,电池的碳电极与直流电源的正极相连 | |
| D. | 电池总反应为H2+2NiOOH$?_{充电}^{放电}$2Ni(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a+b=14 | B. | a+b=13 | C. | a+b=15 | D. | a+b=7 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com