
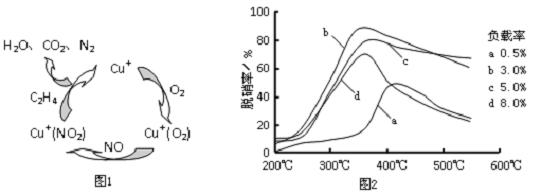
分析 (1)硫的氧化物、氮的氧化物是形成酸雨的主要成因,烟气脱硫、脱硝可以防止酸雨的发生;
(2)①反应中氨气中的N元素由-3价升高为0价,据此计算转移3mol电子参加反应的氨气的物质的量,再根据方程式计算生成的氮气,根据V=nVm计算氮气的体积;
②a、2H2(g)+O2(g)═2H2O (g)△H=-483.6kJ•mol-1
b、N2(g)+3H2(g)═2NH3(g)△H=-92.4kJ•mol-1
c、N2(g)+O2(g)═2NO(g)△H=-180.5kJ•mol-1
依据盖斯定律计算,a×3-b×2-c×3得到反应的热化学方程式;
(3)①图1可知,在催化剂的作用下,C2H4与NO、O2反应最终生成N2、CO2、H2O,据此写出反应的总方程式;
②为达到最佳脱硝效果,应满足脱硝率高,负载率低,适宜的温度.
解答 解:(1)烟气脱硫、脱硝可以降低硫的氧化物、氮的氧化物含量,防止酸雨的发生,
故答案为:防止酸雨的发生;
(2)①反应中氨气中的N元素由-3价升高为0价,化合价升高3价,泽尔转移3mol电子参加反应的氨气的物质的量为:$\frac{3mol}{3}$=1mol,根据方程式可知生成的氮气的物质的量为:1mol×$\frac{3+2x}{4x}$=$\frac{3+2x}{4x}$mol,
氮气的体积为:$\frac{3+2x}{4x}$mol×22.4L/mol=$\frac{16.8+11.2x}{x}$L,
故答案为:$\frac{16.8+11.2x}{x}$;
②a、2H2(g)+O2(g)═2H2O (g)△H=-483.6kJ•mol-1
b、N2(g)+3H2(g)═2NH3(g)△H=-92.4kJ•mol-1
c、N2(g)+O2(g)═2NO(g)△H=-180.5kJ•mol-1
依据盖斯定律计算,a×3-b×2-c×3得到反应的热化学方程式为:6NO(g)+4NH3(g)═5N2(g)+6H2O(g)的△H=-724.5kJ•mol-1
故答案为:-724.5kJ•mol-1;
(3)①根据图1可知,在催化剂的作用下,C2H4与NO、O2反应最终生成N2、CO2、H2O,反应总方程式为:6NO+3O2+2C2H4$\frac{\underline{\;催化剂\;}}{\;}$3N2+4CO2+4H2O,
故答案为:6NO+3O2+2C2H4$\frac{\underline{\;催化剂\;}}{\;}$3N2+4CO2+4H2O;
②由图可知,b曲线的最高点处,脱硝率高,负载率低,温度温度适宜,适宜适合条件为350℃、负载率3%,
故答案为:350℃、负载率3%.
点评 本题以烟气的脱硫和脱硝为载体,考查环境保护、氧化还原反应计算、方程式书写等知识,题目难度中等,本题注意把握数据处理和图象分析.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 化学键 | H-H | H-F | H-Br | H-I |
| 键能(kJ/mol) | 436 | 565 | 368 | 297 |
| A. | 氢气 | B. | 氟化氢 | C. | 溴化氢 | D. | 碘化氢 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 开始沉淀的pH | 沉淀完全的pH | |
| Fe3+ | 1.1 | 3.2 |
| Mn2+ | 8.3 | 9.8 |
| Cu2+ | 4.4 | 6.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol任何气体的体积约是22.4L | |
| B. | 标准状况下,1mol H2O 所占的体积约为22.4L | |
| C. | 常温常压下,1mol O2 所占的体积约为22.4L | |
| D. | 标准状况下,体积为22.4LN2 和N2O 的混合气体,其中约含有2mol N 原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 纯盐酸、空气、硫酸、干冰 | B. | 蒸馏水、氨水、碳酸氢钠、二氧化硫 | ||
| C. | 胆矾、盐酸、铁、碳酸钙 | D. | 生石灰、浓硫酸、氯化铜、碳酸钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 甲 | 乙 | 丙 | 丁 | 戊 | |
| 化合物中各元 素原子个数比 | A:C=1:1 | A:B=1:1 | D:C=1:1 | E:F=1:3 | B:F=1:4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com