



 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
| 2 | 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:2012-2013年湖北省仙桃市毛嘴高中高二上学期学业水平监测试化学卷(带解析) 题型:填空题
((9分) (1)在配合物离子(FeSCN)2+中,提供空轨道接受孤对电子的微粒是 。
(2)根据VSEPR模型,H3O+的分子立体结构为 ,BCl3的构型为 。
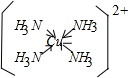
(3)Cu2+能与NH3、H2O、Cl-等形成配位数为4的配合物。
①[Cu(NH3)4]2+中存在的化学键类型有 (填序号)。
| A.配位键 | B.离子键 |
| C.极性共价键 | D.非极性共价键 |
查看答案和解析>>
科目:高中化学 来源:2014届湖北省仙桃市高二上学期学业水平监测试化学卷(解析版) 题型:填空题
((9分) (1)在配合物离子(FeSCN)2+中,提供空轨道接受孤对电子的微粒是 。
(2)根据VSEPR模型,H3O+的分子立体结构为 ,BCl3的构型为 。
(3)Cu2+能与NH3、H2O、Cl-等形成配位数为4的配合物。
①[Cu(NH3)4]2+中存在的化学键类型有 (填序号)。
A.配位键 B.离子键
C.极性共价键 D.非极性共价键
②[Cu(NH3)4]2+具有对称的空间构型,[Cu(NH3)4]2+中的两个NH3被两个Cl-取代,能得到两种不同结构的产物,则[Cu(NH3)4]2+的空间构型为 。
(4)已知Ti3+可形成配位数为6,颜色不同的两种配合物晶体,一种为紫色,另一为绿色。两种晶体的组成皆为TiCl3?6H2O。为测定这两种晶体的化学式,设计了如下实验:
a.分别取等质量的两种配合物晶体的样品配成待测溶液;
b.分别往待测溶液中滴入AgNO3溶液,均产生白色沉淀;
c.沉淀完全后分别过滤得两份沉淀,经洗涤干燥后称量,发现原绿色晶体的水溶液得到的白色沉淀质量为紫色晶体的水溶液反应得到沉淀质量的2/3。绿色晶体配合物的化学式为 ,由Cl所形成的化学键类型是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com