

 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:不详 题型:填空题
 丙+丁+水。
丙+丁+水。 。
。 。
。 MnO4- +
MnO4- +  SO2 +
SO2 +  =
=  Mn2+ +
Mn2+ +  SO42- +
SO42- +  H+
H+ 2SO3(g) △H< 0反应。该反应的化学平衡常数K= (填表达式);反应达平衡时,若改变其中一个条件x,则符合图中曲线的是 (填序号)。
2SO3(g) △H< 0反应。该反应的化学平衡常数K= (填表达式);反应达平衡时,若改变其中一个条件x,则符合图中曲线的是 (填序号)。
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.原子半径大小为Z>Y>X>W |
| B.W与X形成的化合物中可能含有共价键 |
| C.W的气态氢化物的沸点一定高于Z的气态氢化物的沸点 |
| D.若W与Y的原子序数相差5,则二者形成化合物的化学式一定为Y2W3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.常温下,4.48L 35 17Cl2含有0.72NA个中子 |
| B.37 17Cl、35 17Cl互为同位素,35 17Cl2与37 17Cl2互为同分异构体 |
| C.通常情况下,氯气做氧化剂,但氯气也具有还原性 |
| D.37 17Cl2的摩尔质量是74 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.最外层有6个电子 |
| B.该元素为过渡元素 |
| C.最高化合价为+4价 |
| D.电解硝酸铜与硝酸“类铅”的混合溶液时首先会析出“类铅” |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题

 为① ② ;(4分)
为① ② ;(4分) (3分)
(3分)查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

 期主族元素A、B、C、D、E原子序数依次增大,A元素单质常温常压下是最轻的气体,B元素所形成化合物种类最多,C的最高价氧化物对应水化物甲与其气态氢化物乙能够化合形成盐丙;D元素的离子半径是同周期元素形成的简单离子中最小的。
期主族元素A、B、C、D、E原子序数依次增大,A元素单质常温常压下是最轻的气体,B元素所形成化合物种类最多,C的最高价氧化物对应水化物甲与其气态氢化物乙能够化合形成盐丙;D元素的离子半径是同周期元素形成的简单离子中最小的。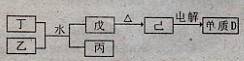
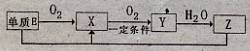
 所生成R的含氧酸盐只有一种,则该含氧酸盐的化学式是 。
所生成R的含氧酸盐只有一种,则该含氧酸盐的化学式是 。查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com