

| 所含离子 | 检验方法 |
| K+ | 取少量滤液于试管中,通过焰色反应,火焰呈紫色(透过蓝色钴玻璃) |
| NH4+ | 取少量滤液于试管中,并向其中加入NaOH微热,有刺激性气味产生(该气体可使湿润红色石蕊试纸变蓝) |
分析 流程图分析:吸收环节:2NH3+CO2+H2O生成碳酸铵;转化Ⅰ环节:碳酸铵和石膏悬浊液反应生成CaCO3+(NH4)2SO4,经过滤后分离;转化Ⅱ:(NH4)2SO4和KCl的饱和溶液反应得到NH4Cl和K2SO4经过滤Ⅱ分离;蒸氨环节的为CaO、H2O、NH4Cl生成为CaCl2.6H2O和NH3,
(1)根据工艺中涉及的微粒进行答题;
(2)C是空气中含量最多的元素,即为N,F原子的N层电子数与K层电子数相同,即为Ca,F与B、D都可形成XY2型离子化合物FB2、FD2,所以推知B是C,过氧化钙和碳化钙均能和水反应产生氧气,所以D是O,C22-与N2是原子数均为2、电子数是14的等电子体,O22-与F2是电子数为18的等电子体,所以E是F,
①电子排布一样的离子,则核电荷数越多半径越小;
②根据非金属单质间的置换反应可以确定非金属的非金属性强弱;
③阴阳离子间通过静电作用形成的化学键是离子键,含有离子键的化合物是离子化合物;
(3)根据流程分析可知,过滤Ⅱ所得滤液中大量含有的阳离子有K+、NH4+,根据K+通过焰色反应检验,NH4+用氢氧化钠溶液检验;根据元素守恒写总反应方程式.
解答 解:流程图分析:吸收环节:2NH3+CO2+H2O生成碳酸铵;转化Ⅰ环节:碳酸铵和石膏悬浊液反应生成CaCO3+(NH4)2SO4,经过滤后分离;转化Ⅱ:(NH4)2SO4和KCl的饱和溶液反应得到NH4Cl和K2SO4经过滤Ⅱ分离;蒸氨环节的为CaO、H2O、NH4Cl生成为CaCl2.6H2O和NH3,
(1)根据工艺中涉及的微粒可知,具有相同电子数的粒子的化学式为NH3、H2O、NH4+、OH-、H3O+,
故答案为:NH3、H2O、NH4+、OH-、H3O+五种的任意四种;
(2)C是空气中含量最多的元素,即为N,F原子的N层电子数与K层电子数相同,即为Ca,F与B、D都可形成XY2型离子化合物FB2、FD2,所以推知B是C,过氧化钙和碳化钙均能和水反应产生氧气,所以D是O,C22-与N2是原子数均为2、电子数是14的等电子体,O22-与F2是电子数为18的等电子体,所以E是F,
①N3-、O2-、F-是核外电子排布一样的离子,则核电荷数越多半径越小,故离子半径大小顺序是:N3->O2->F-,
故答案为:N3->O2->F-;
②氟气能将氧气从其化合物中置换出来,如2F2+2H2O=4HF+O2,证明氟的非金属性强于氧,
故答案为:2F2+2H2O=4HF+O2;
③离子化合物的构成条件:含有阴阳离子间通过静电作用形成的化学键即离子键,非金属之间形成的化学键大多是共价键,由上述元素中的4种构成的离子化合物有:NH4HCO3、(NH4)2CO3、Ca(HCO3)2、(CH3COO)2Ca,
故答案为:NH4HCO3、(NH4)2CO3、Ca(HCO3)2、(CH3COO)2Ca其中两种;离子键、共价键;
(3)①根据流程分析可知,过滤Ⅱ所得滤液中大量含有的阳离子有K+、NH4+,K的检验方法是取少量滤液于试管中,通过焰色反应,火焰呈紫色(透过蓝色钴玻璃)
,NH4+的检验方法是取少量滤液于试管中,并向其中加入NaOH微热,有刺激性气味产生(该气体可使湿润红色石蕊试纸变蓝),
故答案为:K+;取少量滤液于试管中,通过焰色反应,火焰呈紫色(透过蓝色钴玻璃);NH4+;取少量滤液于试管中,并向其中加入NaOH微热,有刺激性气味产生(该气体可使湿润红色石蕊试纸变蓝);
②此工艺的总反应方程式为CaSO4•2H2O+2KCl+4H2O=K2SO4+CaCl2•6H2O,故答案为:CaSO4•2H2O+2KCl+4H2O=K2SO4+CaCl2•6H2O.
点评 本题为工艺流程题,涉及原料、产品的判断、方程式的书写、检验等.做推断题时要充分利用所给的信息,结合自己已学过的知识,进行有依据性的推测,难度较大.


科目:高中化学 来源: 题型:解答题
 (1)纯净物根据其组成和性质可进行如下分类:
(1)纯净物根据其组成和性质可进行如下分类:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源:2016-2017学年辽宁沈阳东北育才学校高二阶段考一化学卷(解析版) 题型:选择题
恒温(1100℃)恒容密闭容器中发生反应:Na2SO4(s)+4H2(g) Na2S(s)+4H2O(g).下列说法正确的是( )
Na2S(s)+4H2O(g).下列说法正确的是( )
A.该反应的平衡常数表达式K=c(H2O)/c(H2)
B.若容器内气体的密度或压强保持不变,均说明该反应已达到平衡状态
C.若Na2SO4足量,改变起始充入H2的浓度,达平衡时H2的转化率不变
D.若初始时投入2.84gNa2SO4与一定量H2,反应达平衡时容器内固体共有2.264g,则Na2SO4的转化率为50%
查看答案和解析>>
科目:高中化学 来源:2016-2017学年辽宁沈阳东北育才学校高二阶段考一化学卷(解析版) 题型:选择题
深海中存在可燃冰(CH4•nH2O固体).已知:CH4•nH2O(s) 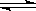 CH4(g)+nH2O(l)﹣Q(Q>0)深海中能够存在可燃冰,是因为深海具有以下条件中的( )
CH4(g)+nH2O(l)﹣Q(Q>0)深海中能够存在可燃冰,是因为深海具有以下条件中的( )
A.低温高压 B.高温低压 C.低温低压 D.高温高压
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH相同的①CH3COONa②NaHCO3两种溶液的c(Na+):②>① | |
| B. | 反应2A(s)+B(g)=2C(g)+D(g)不能自发进行,则该反应△H一定大于0 | |
| C. | 向明矾溶液中逐滴加入氢氧化钡溶液至硫酸根离子刚好沉淀完全时,溶液呈碱性 | |
| D. | 将盛有NO2气体的密闭容器浸泡在热水中,容器内气体颜色变深,这一事实可以用勒夏特列原理解释 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 明矾水解形成的Al(OH)3胶体能吸附水中的悬浮物,可用于水的净化 | |
| B. | 在海轮的外壳镶上锌块,可减缓船体的腐蚀速率 | |
| C. | 用热的纯碱溶液洗碗去污效果好 | |
| D. | 电解熔融的AlCl3可制得金属铝 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com