
对下列化学用语描述和理解都正确的是
原子结构示意图 ,可以表示
,可以表示 ,也表示
,也表示
B. 比例模型 可以表示水分子,也可以表示二氧化碳分子
可以表示水分子,也可以表示二氧化碳分子
C. 结构示意图为 的阴离子都不能破坏水的电离平衡
的阴离子都不能破坏水的电离平衡
D.电子式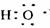 可以表示羟基,也可以表示氢氧根离子
可以表示羟基,也可以表示氢氧根离子
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
据报道,我国拥有完全自主产权的氢氧燃料电池车已经在奥运会期间为运动员提供服务。某种氢氧燃料电池的电解液为KOH溶液。下列有关电池的叙述不正确的是( )
A.负极反应式为2H2+4OH--4e-====4H2O
B.工作一段时间后,电解液中的KOH的物质的量不变
C.该燃料电池的总反应方程式为:2H2+O2====2H2O
D.用该电池电解CuCl2溶液,产生2.24 L Cl2(标准状况)时,有0.1 mol电子转移
查看答案和解析>>
科目:高中化学 来源: 题型:
汽车在现代生活中扮演着越来越重要的角色,但其尾气(碳氢化合物、氮氧化物及一氧化碳等)带来的环境污染越来越明显,机动车废气排放已成为城市大气污染的重要来源.
(1)在汽车尾气系统中安装催化转换器,可有效减少尾气中的CO、NOx 和碳氢化合物等废气.
已知:N2(g)+O2(g)=2NO(g)△H1=+180kJ/mol
CO(g)+ O2(g)=CO2(g)△H2=﹣283kJ/mol
O2(g)=CO2(g)△H2=﹣283kJ/mol
2NO(g)+2CO(g)=2CO2(g)+N2(g)△H3则△H3= kJ•mol﹣1.
(2)气缸中生成NO的反应为:N2(g)+O2(g)═2NO(g)△H>0
①汽车启动后,气缸内温度越高,单位时间内NO排放量越大,原因是 .
②1mol空气中含有0.8molN2和0.2molO2,1300℃时在含1mol空气的密闭容器内反应达到平衡,测得NO为8×10﹣4mol.计算该温度下的平衡常数K≈ .
(3)尾气中的CO主要来自于汽油不完全燃烧.
①有人设想按下列反应除去CO:2CO(g)=2C(s)+O2(g)△H=+221kJ•mol﹣1,简述该设想能否实现的依据:
②测量汽车尾气的浓度常用电化学气敏传感器,其中CO传感器可用如图1简单表示,则阳极发生的电极反应为 .
(4)汽车尾气中的CO可转化为甲烷,方程式为CO(g)+3H2(g)⇌CH4(g)+H2O(g).其他条件相同时,H2的平衡转化率在不同压强下随温度的变化如图2所示.
①该反应的△H 0(填“<”、“=”或“>”).
②实际生产中采用图中M点而不是N点对应的反应条件,运用化学反应速率和平衡知识,同时考虑生产实际,说明选择该反应条件的理由 .
查看答案和解析>>
科目:高中化学 来源: 题型:
在298 K时,实验测得溶液中的反应:H2O2+2HI====2H2O+I2,在不同浓度时的化学反应速率见下表,由此可推知当c(HI)=0.500 mol·L-1,c(H2O2)=0.400 mol·L-1时的反应速率为( )
| 实验编号 | 1 | 2 | 3 | 4 | 5 |
| c(HI)/mol·L-1·min-1 | 0.100 | 0.200 | 0.300 | 0.100 | 0.100 |
| c(H2O2)/mol·L-1·min-1 | 0.100 | 0.100 | 0.100 | 0.200 | 0.300 |
| v/mol·L-1·s-1 | 0.007 60 | 0.015 3 | 0.022 7 | 0.015 1 | 0.022 8 |
A.0.038 0 mol·L-1·s-1 B.0.152 mol·L-1·s-1
C.0.608 mol·L-1·s-1 D.0.760 mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
某研究小组在实验室用三份不同初始浓度的氨基甲酸铵(NH2COONH4)溶液在不同温度下进行水解实验:NH2COONH4+2H2O NH4HCO3+
NH4HCO3+
NH3·H2O,测得c(NH2COO-)与反应时间的关系如图所示。据图判断下列说法中正确的是 ( )
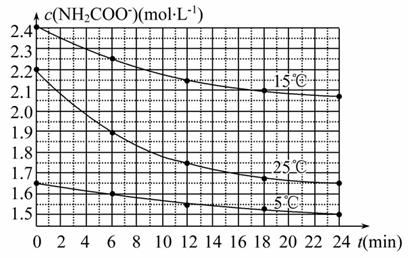
A.0~12 min,初始浓度越大的实验,水解反应速率越大
B.c(NH2COO-)将随反应时间的不断延长而不断减小
C.25 ℃时,0~6 min,v(NH2COO-)为0.05 mol·L-1·min-1
D.15 ℃时,第30 min时,c(NH2COO-)为2.0 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是(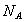 代表阿伏加德罗常数值)
代表阿伏加德罗常数值)
A. 1molNa被完全氧化为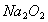 ,失去的电子数为2
,失去的电子数为2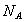
B. 常温常压下,16g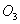 气体含有氧原子数为
气体含有氧原子数为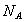
C. 常温常压下,22.4L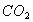 含有的分子数为
含有的分子数为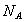
D. 18g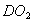 所含的电子数为10
所含的电子数为10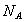
查看答案和解析>>
科目:高中化学 来源: 题型:
到目前为止,由化学能转变为热能或电能仍然是人类使用最主要的能源。
(1)化学反应中放出的热能(焓变,ΔH)与反应物和生成物在反应过程中断键和形成新键过程中吸收和放出能量的大小有关。
已知:H2(g)+Cl2(g)====2HCl(g) ΔH=-185 kJ·mol-1,断裂1 mol H—H键吸收的能量为436 kJ,断裂1 mol Cl—Cl键吸收的能量为247 kJ,则形成1 mol H—Cl键放出的能量为_________。
(2)燃料燃烧将其所含的化学能转变为我们所需要的热能。已知:
①CH4(g)+2O2(g)====CO2(g)+2H2O(l) ΔH=-890.3 kJ·mol-1
②C(s,石墨)+O2(g)====CO2(g) ΔH=-393.5 kJ·mol-1
③2H2(g)+O2(g)====2H2O(l) ΔH=-571.6 kJ·mol-1
标准状况下22.4 L氢气和甲烷的混合气体在足量的氧气中充分燃烧反应放出588.05 kJ的热量,原混合气体中氢气的质量是__________。根据以上三个热化学方程式,计算C(s,石墨)+2H2(g)====CH4(g)的反应热ΔH为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:
(1)H2(g)+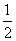 O2(g)===H2O(g) ΔH1=a kJ·mol-1
O2(g)===H2O(g) ΔH1=a kJ·mol-1
(2)2H2(g)+O2(g)===2H2O(g) ΔH2=b kJ·mol-1
(3)H2(g)+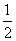 O2(g)===H2O(l) ΔH3=c kJ·mol-1
O2(g)===H2O(l) ΔH3=c kJ·mol-1
(4)2H2(g)+O2(g)===2H2O(l) ΔH4=d kJ·mol-1
下列关系式中正确的是( )
A.a<c<0 B.b>d>0 C.2a=b<0 D.2c=d>0
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com