
分析 反应达到平衡,测得平衡时SO3的物质的量的浓度为0.925mol•L-1,则:
2SO3(g)?2SO2(g)+O2(g)
开始(mol/L):0 1.00 1.00
转化(mol/L):0.925 0.925 0.4625
平衡(mol/L):0.925 0.075 0.5375
代入平衡常数表达式K=$\frac{{c}^{2}(S{O}_{2})×c({O}_{2})}{{c}^{2}(S{O}_{3})}$计算.
解答 解:反应达到平衡,测得平衡时SO3的物质的量的浓度为0.925mol•L-1,则:
2SO3(g)?2SO2(g)+O2(g)
开始(mol/L):0 1.00 1.00
转化(mol/L):0.925 0.925 0.4625
平衡(mol/L):0.925 0.075 0.5375
则平衡常数K=$\frac{{c}^{2}(S{O}_{2})×c({O}_{2})}{{c}^{2}(S{O}_{3})}$=$\frac{0.07{5}^{2}×0.5375}{0.925}$=0.0327
答:1000K时反应2SO3(g)?2SO2(g)+02(g)的平衡常数为0.0327.
点评 本题考查化学平衡的有关计算,涉及平衡常数计算,比较基础,注意对基础知识的理解掌握.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 称取1.44g硫酸铜,配成100mL溶液 | B. | 称取2.25g胆矾,加入100mL水 | ||
| C. | 称取1.6g硫酸,加入100mL水 | D. | 称取2.5g胆矾,配成100mL溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ,丁分子的结构式为H-$\stackrel{\stackrel{H}{/}}{N}$-$\stackrel{\stackrel{H}{/}}{N}$-H,丙属于极性分子(填“极性”或“非极性”)
,丁分子的结构式为H-$\stackrel{\stackrel{H}{/}}{N}$-$\stackrel{\stackrel{H}{/}}{N}$-H,丙属于极性分子(填“极性”或“非极性”)查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 工业设计用CO2来生产燃料甲醇,既减少二氧化碳气体,又得到了宝贵的能源物质.为了探究反应原理,先进行如下实验:在体积为1L的恒容密闭容器中,充入1mol CO2和3mol H2,在某温度下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g);△H=-49.0kJ/mol.测得CO2和CH3OH(g)的浓度随时间变化如图所示.
工业设计用CO2来生产燃料甲醇,既减少二氧化碳气体,又得到了宝贵的能源物质.为了探究反应原理,先进行如下实验:在体积为1L的恒容密闭容器中,充入1mol CO2和3mol H2,在某温度下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g);△H=-49.0kJ/mol.测得CO2和CH3OH(g)的浓度随时间变化如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 | B. | 2 | C. | 3 | D. | 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
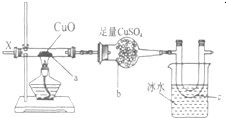 按图装置,持续通入X气体,可以看到a处有红色物质生成,b处变蓝,c处得到刺激性气味的液体,则X气体可能是( )
按图装置,持续通入X气体,可以看到a处有红色物质生成,b处变蓝,c处得到刺激性气味的液体,则X气体可能是( )| A. | ①③ | B. | ① | C. | ③④ | D. | ⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,11.2L CO2所含的原子数为1.5NA | |
| B. | 常温常压下,48g O2含有的氧原子数为3NA | |
| C. | 标准状况下,22.4L H2中所含原子数为NA | |
| D. | 标准状况下,22.4L 四氯化碳的分子数为NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com