
| △c |
| △t |
| ||
| 1s |
| 4mol |
| 2L |
| 4mol |
| 8mol |
| 4mol |
| 10mol |


 寒假学与练系列答案
寒假学与练系列答案科目:高中化学 来源: 题型:
| A、实验室制乙烯:C2H2+H2→C2H4 | ||
| B、用醋酸除去水垢:CaCO3+2H+═Ca2++H2O+CO2↑ | ||
| C、乙醇和钠反应:CH3CH2OH+Na→CH3CH2ONa+2H2↑ | ||
D、实验室用液溴和苯在催化剂作用下制溴苯: +Br2 +Br2
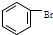 +HBr +HBr |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
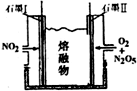 利用N2和H2可以实验NH3的工业合成,而氨又可以进一步制备硝酸,在工业上一般可进行连续生产.请冋答下列问题:
利用N2和H2可以实验NH3的工业合成,而氨又可以进一步制备硝酸,在工业上一般可进行连续生产.请冋答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 族周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | A | |||||||
| 2 | D | E | G | |||||
| 3 | B | C | J | F | H | I |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com