
| A. | HS-+H2O?H3O++S2- | B. | CO2+2 H2O?HCO3-+H3O+ | ||
| C. | NH4++2H2O?NH3•H2O+H3O+ | D. | HCO3-+OH-?CO32-+H2O |
分析 水解反应中有水参加反应,为弱酸离子或弱碱离子与水电离的氢离子或氢氧根离子结合生成弱电解质的反应,以此来解答.
解答 解:A.HS-+H2O?H3O++S2-为HS-的电离方程式,故A不选;
B.CO2+2 H2O?HCO3-+H3O+为碳酸的第一步电离方程式,故B不选;
C.NH4++2H2O?NH3•H2O+H3O+为铵根离子的水解方程式,故C选;
D.碳酸氢根离子和氢氧根离子之间反应生成碳酸根离子和水,不属于水解反应,是发生了化学反应,故D不选;
故选C.
点评 本题考查离子反应,侧重水解的离子反应的考查,明确水解的离子反应、电离的离子反应、化学反应中的离子反应即可解答,注重反应类型的分析,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
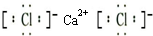 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe$→_{高温}^{Al_{2}O_{3}}$Al$\stackrel{NaOH(aq)}{→}$H2 | |
| B. | MgCl2•6H2O$→_{△}^{HCl}$MgCl2$\stackrel{熔融电解}{→}$Mg | |
| C. | NH3$→_{催化剂}^{O_{2}}$NO$\stackrel{NaOH(aq)}{→}$NaNO2 | |
| D. | SO2$\stackrel{BaCl_{2}(aq)}{→}$BaSO3(s)$\stackrel{O_{2}}{→}$BaSO4(s) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 当容器中混合气体的压强不再变化时,反应达到平衡 | |
| B. | 平衡后加入少量W,逆反应速率增大 | |
| C. | 平衡后升高温度,平衡逆向移动 | |
| D. | 平衡后加入X,△H增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀硝酸是弱酸,浓硝酸是强酸 | |
| B. | 稀硝酸与活泼金属反应主要放出氢气,而浓硝酸则通常使金属钝化 | |
| C. | 浓硝酸、稀硝酸和浓硫酸都是强氧化剂 | |
| D. | 室温下,铜既可与浓硝酸反应,又可与稀硫酸反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
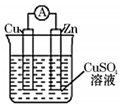
| A. | 锌棒为负极 | B. | 锌棒发生氧化反应 | ||
| C. | 反应后铜棒质量增重 | D. | 电子从铜棒经外电路流向锌棒 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 纯银器的表面在空气中因化学腐蚀渐渐变暗 | |
| B. | 当镀锡铁制品的镀层破损时,镀层不能对铁制品起保护作用 | |
| C. | 在海轮外壳连接锌块保护外壳不受腐蚀是采用了牺牲阳极的阴极保护法 | |
| D. | 可将地下输油钢管与外加直流电源的正极相连以保护它不受腐蚀 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com