
【题目】混合气体由N2和CH4组成,测得混合气体在标准状况下的密度是0.821g/L,则混合气体中N2和CH4的体积之比为( )
A. 5∶1 B. 4∶1 C. 1∶4 D. 1∶5
 一卷搞定系列答案
一卷搞定系列答案 名校作业本系列答案
名校作业本系列答案 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案科目:高中化学 来源: 题型:
【题目】硫化钠是一种重要的化工原料.工业上用硫酸钠来制得硫化钠.制备硫化钠的反应原理为:Na2SO4(s)+4H2(g)Na2S(s)+4H2O(g)﹣Q,已知该可逆反应在1000℃时达到平衡,并保持反应器内恒温恒容.试回答下列问题:
(1)此可逆反应的平衡常数表达式可表示为 , 若只改变一个影响因素,当平衡移动时,K值变化(填“一定”或“不一定”);当K值变大时,逆反应速率 . (填“增大”、“减小”或“不变”)
(2)该反应达到平衡时下列说法错误的是 . a.容器内压强保持不变
b.氢气和水蒸汽的物质的量之比保持不变
c.加入少量Fe3O4固体,平衡向逆反应方向移动
d.移除部分Na2S固体,平衡向正反应方向移动
(3)该温度下,在2L盛有2.84g Na2SO4的密闭容器中通入H2气体,10分钟后测得固体质量为2.264g.则10分钟内H2的平均反应速率为 .
(4)往Ba(ClO)2溶液中通入足量SO2气体后,溶液中的溶质是 .
(5)向亚硫酸钠中滴加酚酞,溶液变为红色,若在该溶液中再滴入过量的BaCl2溶液,现象是 , 请结合离子方程式,运用平衡原理进行解释: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度,在1L恒容密闭容器中,加入10molCO、7molH2S,发生如下反应:CO(g)+H2S(g)COS(g)+H2(g),达平衡时CO物质的量为8mol,下列说法正确的是( )
A.该温度下,化学平衡常数K=0.1
B.H2S的平衡转化率为20%
C.增大CO浓度,平衡正向移动,可以提高CO的转化率
D.升高温度,H2S浓度增加,表明该反应正方向是吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙醇是生活中常接触到的一种有机化合物,请回答下列问题
(1)饭店中常使用固体酒精,你判断它应是(填混合物或纯净物),质量较差的固体酒精在使用时因燃烧不充分,可能产生有毒气体(写化学式);
(2)在焊接铜漆包线的线头时,常先把线头放在火上烧一下以除去漆层,并立即在酒精中蘸一下就可得光亮的铜线,这个过程中乙醇发生(填氧化反应或还原反应);
(3)乙醇和乙酸可以发生酯化反应,请写出化学方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CaCO3的摩尔质量为100g/mol,将5.0g CaCO3固体完全溶于稀盐酸后,再用蒸馏水稀释成100mL溶液.该溶液中Ca2+ 的物质的量浓度为( )
A. 5.0 mol/L B. 0.50 mol/L C. 1.0 mol/L D. 0.10 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃时,某稀溶液中由水电离产生的c(OH﹣)=10﹣10 molL﹣1 . 下列有关该溶液的叙述正确的是( )
A.该溶液一定呈酸性
B.该溶液中c(H+)可能等于10﹣5 molL﹣1
C.该溶液的pH可能为4也可能为10
D.该溶液有可能呈中性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的数值。下列有关叙述错误的是
A. 28g 由N2 与CO组成的混合气体中所含的原子数为2NA
B. 78g Na2O2 中所含的阴离子数为NA
C. 0.1molSO2 与0.1molO2充分反应后生成的SO2分子数为0.1 NA
D. 0.1molCu溶于足量稀硝酸中,转移的电子数为0.2 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨是人类科学技术上的一项重大突破,其反应原理为:
N2(g)+3H2(g)2NH3(g)△H=﹣92.4kJmol﹣1
一种工业合成氨的简易流程图如下: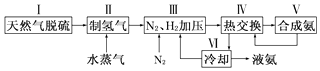
(1)在密闭容器中,使2mol N2和6mol H2混合发生下列反应:N2(g)+3H2(g)2NH3(g)(正反应为放热反应)当反应达到平衡时,N2和H2的浓度比是 . 升高平衡体系的温度(保持体积不变),该反应(填“逆向移动”正向移动”或“不移动”).
(2)氨水、氯水中均存在多种微粒和多个平衡,请写出氯水中存在的一个化学平衡反应的离子方程式 .
(3)步骤Ⅱ中制氢气原理如下:
①CH4(g)+H2O(g)CO(g)+3H2(g)△H=+206.4kJmol﹣1
②CO(g)+H2O(g)CO2(g)+H2(g)△H=﹣41.2kJmol﹣1
对于反应①,一定可以提高平衡体系中H2百分含量,又能加快反应速率的措施是 .
a.升高温度 b.增大压强 c.加入催化剂 d.降低压强
利用反应②,将CO进一步转化,可提高H2产量.若2mol CO和H2的混合气体(H2的体积分数为80%)与H2O反应,得到2.28mol CO、CO2和H2的混合气体,则CO转化率为
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,将1mol的CuSO45H2O(s)溶于水会使溶液温度降低,其过程表示为:
CuSO45H2O(s)=Cu2+(aq)+SO42﹣(aq)+5H2O(l) 热效应为△H1;将 1mol CuSO4(s)溶于水会使溶液温度升高,其过程表示为:CuSO4(s)=Cu2+(aq)+SO42﹣(aq) 热效应为△H2;CuSO45H2O受热分解的化学方程式为:CuSO45H2O(s) ![]() CuSO4(s)+5H2O(l),热效应为△H3 . 则下列判断正确的是( )
CuSO4(s)+5H2O(l),热效应为△H3 . 则下列判断正确的是( )
A.△H1<△H3
B.△H2>△H3
C.△H1+△H3=△H2
D.△H1+△H2>△H3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com