
(一)选择方案
方案Ⅰ:用硫酸与铝屑反应,生成Al2(SO4)3后,再用氢氧化钠(或氨水)使Al(OH)3沉淀析出。化学方程式:
2Al2+3H2SO4====Al2(SO4)3+3H2↑
Al2(SO4)3+6NaOH====2Al(OH)3↓+3Na2SO4
或Al2(SO4)3+6NH3·H2O====2Al(OH)3↓+3(NH4)2SO4
方案Ⅱ:将铝屑跟浓NaOH溶液反应,生成NaAlO2,再用稀硫酸与NaAlO2反应生成Al(OH)3沉淀析出。化学方程式:
2Al+2NaOH+2H2O====2NaAlO2+3H2↑
2NaAlO2+ H2SO4+2H2O====2Al(OH)3↓+Na2SO4
方案Ⅲ:用铝屑分别与稀硫酸和浓NaOH溶液反应,然后将得到的铝盐溶液混合,即可得到Al(OH)3沉淀析出。化学方程式:
2Al2+3H2SO4====Al2(SO4)3+3H2↑
2Al+2NaOH+2H2O====2NaAlO2+3H2↑
Al2(SO4)3+6NaAlO2+12H2O====8Al(OH)3↓+3Na2SO4
(二)实验方案的评价
对上述三个方案来说,从反应物种类来看,三种方案都使用了三种药品。从耗酸、碱的量来看,方案Ⅰ用量最多,方案Ⅲ用量最少;从操作要求来考虑,方案Ⅲ也最简单。因此应选方案Ⅲ。
(三)实验方案的设计
实验名称:以铝屑为原料制备Al(OH)3 。
实验目的:
1.分析并评价制备Al(OH)3的最佳方案,培养对实验的分析能力;
2.认识铝的化学性质和 Al(OH)3的两性。
实验用品:烧杯、量筒、玻璃棒、天平、铁架台、漏斗、滤纸、酒精灯、火柴、
铝屑、稀硫酸、稀NaOH溶液、蒸馏水、浓NaOH溶液
实验步骤 :
1.在烧杯1中倒入50 mL稀NaOH溶液,加入足量铝屑,给溶液稍加热,待1—2 min后,将铝屑用蒸馏水洗净,干燥后称量铝屑的质量(m1),将铝屑分成四等份,备用;
2.在烧杯2中放入1份铝屑,再加入适量稀硫酸,使铝屑全部溶解得溶液①;
3.在烧杯3中放入3份铝屑,再加入适量浓NaOH溶液,使铝屑全部溶解得溶液②;
4.将溶液①和溶液②混合,将沉淀过滤;
5.把沉淀转移到烧杯里,用蒸馏水洗涤3次,再过滤,再洗涤,至溶液的pH为7—8;
6.过滤、干燥,得到的固体为Al(OH)3;
7.称量Al(OH)3的质量(m2),计算产率。
实验现象记录及实验结果处理
实验现象:
实验结果处理:铝屑的质量为m1,Al(OH)3的理论产量为78 m1/27,Al(OH)3的实际产量为m2。本实验Al(OH)3的产率为:
![]() ×100%=
×100%=![]()


 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案科目:高中化学 来源:物理教研室 题型:013
A.Cu+浓HNO3
B.Cu+稀HNO3
C.Cu+AgNO3
D.![]()
其中最好的是_______.理由是_____________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
A.1∶1 B.3∶1 C.4∶3 D.3∶4
查看答案和解析>>
科目:高中化学 来源: 题型:
下面是以铝屑为原料制备Al(OH)3的三种实验设计方案:
方案一:用稀硫酸跟铝屑反应,使铝转化成Al3+的溶液,再用NaOH溶液使Al(OH)3沉淀析出。
方案二:将铝屑与NaOH溶液反应,再用稀硫酸中和过量的碱液,与[Al(OH)4]-反应以得到Al(OH)3。
方案三:用铝屑分别与稀硫酸和浓NaOH溶液反应,然后将得到的盐溶液混合过滤,再将得到的沉淀洗涤,即可得到Al(OH)3。
综合比较以上三种实验设计方案,你认为哪种方案最好?
查看答案和解析>>
科目:高中化学 来源:模拟题 题型:实验题
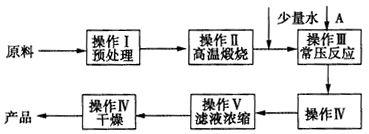
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com