
原子序数由小到大排列的四种短周期元素X、Y、Z、W,四种元素的原子序数之和为32,在周期表中X是原子半径最小的元素,Y、Z左右相邻,Z、W位于同主族。
(1)用电子式表示X与W组成的化合物的形成过程 ;
(2)由X与Z组成的某化合物中存在非极性键,则该化合物的分子式为 ;
(3)由X、Y、Z、W四种元素中的三种组成的一种强酸,该强酸的稀溶液不能与铜反应,浓溶液能与铜在加热条件下反应,该反应的化学方程式为: ;
(4)由X、Y、Z、W四种元素组成的一种离子化合物A
①已知1molA能与足量NaOH浓溶液反应生成标准状况下44.8L气体。写出加热条件下A与NaOH浓溶液反应的离子方程式: ;
②又知A既能与盐酸反应,又能与氯水反应,写出与盐酸反应的离子方程式: ;
(5)由X、Y、Z、W和Fe五种元素组成的式量为392的化合物B,1molB中含有6 mol结晶水。对化合物B进行如下实验:
取B的溶液加入足量的NaOH溶液并加热,产生白色沉淀和无色刺激性气味气体。过一段时间白色沉淀变为灰绿色,最终变为红褐色;
另取B的溶液,加入过量的BaCl2溶液产生白色沉淀,加盐酸沉淀不溶解.
由上述实验现象可知:B的化学式为 。
(12分)(1)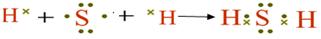
(2)H2O2 (3)Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
(4)①NH4++OH- NH3↑+H2O ②SO32- + 2H+= SO2↑+H2O
NH3↑+H2O ②SO32- + 2H+= SO2↑+H2O
(5)Fe SO4 ·(NH4)2 SO4·6H2O
【解析】
试题分析:在周期表中X是原子半径最小的元素,所以X是氢元素。是Y的原子序数是a,则根据Y、Z左右相邻,Z、W位于同主族可知,Z的原子序数是a+1,W的原子序数是a+9,则1+a+a+1+a+9=32,解得a=7,所以Y是氮元素,Z是氧元素,W是S元素。
(1)S和H形成的化合物是共价化合物,其形成过程是
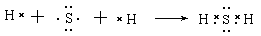 。
。
(2)H和O形成的含有非极性键的是双氧水,化学式是H2O2。
(3)该强酸是硫酸,浓硫酸和铜反应的化学方程式是Cu+2H2SO4(浓)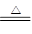 CuSO4+SO2↑+2H2O。
CuSO4+SO2↑+2H2O。
(4)①1molA能与足量NaOH浓溶液反应生成标准状况下44.8L气体,这说明A应该是铵盐。其中氨气的物质的量是2mol,所以A是硫酸铵,因此该反应的离子方程式是NH4++OH-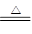 NH3↑+H2O。
NH3↑+H2O。
②A既能与盐酸反应,又能与氯水反应,这说明A应该是亚硫酸氢钠,具有还原性,所以反应的离子方程式是SO32- + 2H+=SO2↑+H2O。
(5)取B的溶液加入足量的NaOH溶液并加热,产生白色沉淀和无色刺激性气味气体。过一段时间白色沉淀变为灰绿色,最终变为红褐色,这说明B中含有NH4+和亚铁离子。另取B的溶液,加入过量的BaCl2溶液产生白色沉淀,加盐酸沉淀不溶解,这说明B中还含有SO42-,因此B的化学式Fe SO4·(NH4)2 SO4·6H2O。
考点:考查元素周期表的结构、化学用语的书写、物质的检验
点评:本题主要是元素“位、构、性”三者关系的综合考查,比较全面考查学生有关元素推断知识和灵活运用知识的能力。考查学生对元素周期表的熟悉程度及其对表中各元素性质和相应原子结构的周期性递变规律的认识和掌握程度。考查了学生对物质结构与性质关系以及运用元素周期律解决具体化学问题的能力。该题还需要注意的是进行物质的检验时,要依据物质的特殊性质和特征反应,选择适当的试剂和方法,准确观察反应中的明显现象,如颜色的变化、沉淀的生成和溶解、气体的产生和气味、火焰的颜色等,进行判断、推理、验证即可。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
 H2SO3、H2SO3
H2SO3、H2SO3 H++HSO3-
H++HSO3- H2SO3、H2SO3
H2SO3、H2SO3 H++HSO3-
H++HSO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
 X、Y、Z、W为按原子序数由小到大排列的四种短周期元素.已知:①X可分别与Y、W形成X2Y,X2Y2、XW等共价化合物;②Z可分别与Y、W形成Z2Y、Z2Y2、ZW等离子化合物.
X、Y、Z、W为按原子序数由小到大排列的四种短周期元素.已知:①X可分别与Y、W形成X2Y,X2Y2、XW等共价化合物;②Z可分别与Y、W形成Z2Y、Z2Y2、ZW等离子化合物.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com