
室温下,下列各组离子能大量共存的是
A.稀硫酸中:K+、Mg2+、AlO2-、S2O32-
B.Na2S溶液中:SO42-、K+、Cl-、Cu2+
C.Kw/c(H+)=10-13mol/L溶液中,Fe3+、NH4+、Mg2+、SO42-
D.通入大量CO2的溶液中:Na+、ClO-、CH3COO-、HCO3-
科目:高中化学 来源:2015-2016学年吉林省松原市高二下期中化学试卷(解析版) 题型:填空题
在标准状况下,将224 L HCl气体溶于635 mL水中,所得盐酸的密度为1.18 g·cm-3。试计算:
(1)所得盐酸的质量分数和物质的量浓度分别是 、 。
(2)取出这种盐酸100 mL,稀释至1.18 L,所得稀盐酸的物质的量浓度是 。
(3)在40.0 mL 0.065 mol·L-1 Na2CO3溶液中,逐渐加入(2)所稀释的稀盐酸,边加边振荡。若使反应不产生CO2气体,加入稀盐酸的体积最多不超过 mL。
(4)将不纯的NaOH样品1 g(样品含少量Na2CO3和水),放入50 mL 2 mol·L-1的盐酸中,充分反应后,溶液呈酸性,中和多余的酸又用去40 mL 1 mol·L-1的NaOH溶液。蒸发中和后的溶液,最终得到 克固体。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖北省高二5月调研二化学试卷(解析版) 题型:选择题
在一密闭容器中有CH4和O2混合气体共20g,放入足量Na2O2用电火花引燃,使其完全反应,Na2O2增重8g,则原混合气体中O2的质量分数是
A. 80% B.60% C.40% D.33.3%
查看答案和解析>>
科目:高中化学 来源:2016届海南省高三考前押题理综化学试卷(解析版) 题型:选择题
下列各组离子或分子能大量共存,当加入相应试剂后会发生化学变化,且发生反应的离子方程式书写正确的是( )
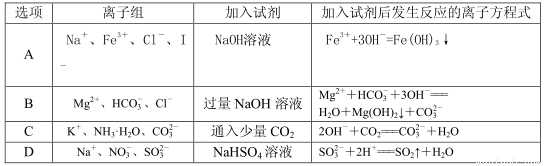
查看答案和解析>>
科目:高中化学 来源:2015-2016学年重庆市高二下第四次月考化学试卷(解析版) 题型:选择题
4.6g铜镁合金完全溶解于100mL密度为1.40g/mL、质量分数为63%的浓硫酸中,得到4480mLNO2和336mLN2O4的混合气体(标准状况),向反应后的溶液中加入1.0mol•L-1NaOH溶液至离子恰好全部沉淀时,下列说法不正确的是
A.该合金中铜与镁的物质的量之比是46:69
B.该浓硝酸中HNO3的物质的量浓度是14.0mol/L
C.产生沉淀8.51g
D.离子恰好完全沉淀时,加入NaOH溶液的体积是230mL
查看答案和解析>>
科目:高中化学 来源:2015-2016学年重庆市高二下第四次月考化学试卷(解析版) 题型:选择题
下列排列的顺序不正确的是
A.热稳定性:HCl>PH3>H2S B.碱性:NaOH>Mg(OH)2>Al(OH)3
C.原子半径:Na>S>O D.结合氢离子能力:CO32->HCO3->SO42-
查看答案和解析>>
科目:高中化学 来源:2015-2016学年贵州省高二下第二次月考化学试卷(解析版) 题型:填空题
铜(Cu)是一种重要的常见金属,现代电子器件的电路离不开它,Cu的化合物在科学研究和工业生产中具有许多用途,如CuSO4溶液常用作电解液、电镀液等。请回答下列问题:
(1) 向CuSO4溶液里逐滴加入氨水,首先生成蓝色难溶物,然后得到深蓝色溶液。由蓝色难溶物得到深蓝色溶液的离子方程式为__________________ ;写出该深蓝色离子能反映出特殊共价键的结构简式________________;
(2) 元素金(Au)处于周期表中的第六周期,与Cu同族。一种铜金合金晶体具有立方最密堆积的结构,在晶胞中Cu原子处于面心、Au原子处于顶角位置,则该合金中Cu原子与Au原子数量之比为________;该晶体中,原子之间的作用力是________________________;
(3) 上述晶体具有储氢功能,氢原子可进入到由Cu原子与Au原子构成的四面体空隙中。若将Cu原子与Au原子等同看待,该晶体储氢后的最简化学式应为________。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年贵州省高二下第二次月考化学试卷(解析版) 题型:选择题
下列说法正确的是
A.冰溶化时,分子中H-O键发生断裂
B.分子晶体中,共价键键能越大,分子晶体的熔沸点越高
C.原子晶体中,共价键越强,熔点越高
D.分子晶体中,分子间作用力越大该物质越稳定
查看答案和解析>>
科目:高中化学 来源:2015-2016学年贵州凯里一中高一下期中理科化学试卷(解析版) 题型:选择题
根据元素周期表和元素周期律分析下面的推断,其中错误的是( )
A.铍(Be)的原子失电子能力比镁弱
B.砹(At)的氢化物不稳定
C.硒(Se)化氢比硫化氢稳定
D.氢氧化锶[Sr(OH)2]比氢氧化钙的碱性强
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com