
| A. | 甲指着氢气燃烧的实验装置说:“一种物质发生反应后,如果有水生成,我认为该物质中一定含有氢元素.” | |
| B. | 乙回答:“可能是这样,但我不能肯定.” | |
| C. | 乙指着实验桌上一瓶无色气体说:“这瓶无色的气体如果点燃后能燃烧并生成水,我认为这是一瓶氢气.” | |
| D. | 甲回答:“可能是这样,但我也不能肯定.” |
分析 A.所有含氢的可燃性物质都能生成水;
B.由于A的结论是以偏概全,所以B应该否定;
C.这里所说的气体是针对桌子上氧气和氢气而言的,不能过于推广开来;
D.由于C说法正确,所以D应该是肯定,而不能继续不确定.
解答 解:在电解水实验和氢气燃烧实验后进行的分析与讨论,所以讨论既有现有的针对性,也有总结性,所以分析时要注意.另外就是这几句话实际是一问一答的形式.
A.“一种纯净物在氧气中燃烧后,如果有水生成,则这种物质一定是氢气”这句话是指着氢气而言的,那么没有这个前提,我们知道所有含氢的可燃性物质都能生成水,故A错误;
B.“可能如此,但我不能肯定”是对A结论的看法,A明显是不正确,所以此处应该是直接否定,而不能两可之间,故B错误;
C.“这瓶无色气体,如果能够点燃,我认为这是一瓶氢气”这句话是指着桌子上的瓶子而言的,由于电解水收集到的气体只有氧气和氢气,所以如果被点燃,只能为氢气,故C错误;
D.由于C是正确的,再说“可能是这样,但我也不能肯定”就不合适,故D错误.
故选C.
点评 本题考查化学实验方案的评价,题目难度不大,解答本题要充分理解各种物质的性质,不能以偏概全,但更重要的是理解四句话的背景和前后关系.


 导学全程练创优训练系列答案
导学全程练创优训练系列答案科目:高中化学 来源: 题型:选择题
| A. | 在水溶液中或熔融状态下能导电的物质 | |
| B. | 凡在水中能生成离子因而能导电的物质 | |
| C. | 氧化钠溶于后水溶液能导电,但溶液中的离子并非本身电离,因而氧化钠是非电解质 | |
| D. | 在水溶液里或熔融状态下本身能电离出阳离子和阴离子,因而是能导电的化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定只含碳元素和氢元素 | |
| B. | 一定含碳、氢、氧三种元素 | |
| C. | 一定含有碳元素和氢元素,可能含氧元素 | |
| D. | 无法判断 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaOH | B. | NaCl | C. | H2O | D. | Na2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 35Cl原子所含质子数为18 | |
| B. | $\frac{1}{18}$ mol的1H35Cl分子所含中子数约为6.02×1023 | |
| C. | 3.5 g的35Cl2气体的体积为2.24 L | |
| D. | 35Cl2气体的摩尔质量为70 g•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 阿伏加德罗常数是12g碳中所含的碳原子数 | |
| B. | 阿伏加德罗常数是 0.012kg12C中所含的原子数 | |
| C. | 阿伏加德罗常数是6.02×1023mol-1 | |
| D. | 阿伏加德罗常数的符号为NA,近似值为6.02×1023mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
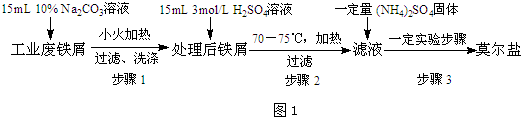
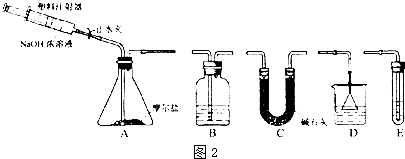
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com