
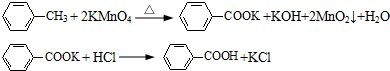
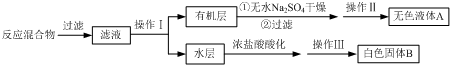

| 2.40×10-3mol×1mol |
| 1mol×0.025mol |
| 1.1712g |
| 1.220g |


科目:高中化学 来源: 题型:
| A、50 mL酸式滴定管;甲基橙 |
| B、50 mL碱式滴定管;酚酞 |
| C、50 mL量筒;石蕊 |
| D、50 mL酸式滴定管;不用指示剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 试管号 | 加入试剂 | 实验现象 | 离子方程式 |
| 1号 | 稀硫酸、H2O2、淀粉液 | 溶液立刻由褐色变成蓝色 | (1) |
| 2号 甲 | 新制的饱和氯水、1%淀粉液 | (2) | 2I-+Cl2=I2+2Cl- |
| 2号 乙 | 新制的饱和氯水、CCl4 | (3) | |
| 3号 | 食用碘盐、稀硫酸、1%淀粉液 | 溶液立刻由无色变成蓝色 | (4) |
查看答案和解析>>
科目:高中化学 来源: 题型:

 ),请在方框内写出合成路线流程(无机试剂任选).注:合成路线流程的书写格式参照如下示例:
),请在方框内写出合成路线流程(无机试剂任选).注:合成路线流程的书写格式参照如下示例:| Cl2 |
| 光照 |
| NaOH/H2O |
| △ |

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验编号 | V(烧碱溶液)/mL | V(HCl)/mL | |
| 初读数 | 末读数 | ||
| 1 | 20.00 | 0.50 | 31.50 |
| 2 | 20.00 | 1.00 | 32.04 |
| 3 | 20.00 | 1.10 | 32.18 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氢氧燃料电池在碱性介质中的负极反应式:H2-2e-=2H+ | ||||
B、用铁棒作阳极、碳棒作阴极电解饱和氯化钠溶液的离子方程式为:2C1-+2H2O
| ||||
| C、粗铜精炼时,与电源正极相连的是纯铜,电极反应式为:Cu-2e-=Cu2+ | ||||
| D、用镀层金属作阳极、镀件作阴极,进行电镀 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com