
往一个容积为5L的密闭容器中,通入2molN2和3molH2,在一定条件下,发生反应 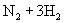

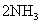 ,2 min后,测得容器中生成了1mol NH3,试求:
,2 min后,测得容器中生成了1mol NH3,试求:
(1)2 min时,N2的物质的量 ;
(2) 2 min时,H2的物质的量浓度 ;
(3)2 min时,H2的转化率 ;
(4)2min内,N2的平均反应速率 ;
(5)N2、H2、NH3的反应速率之比 。
【考点】本题考查化学平衡的有关计算,题目难度不大,注意把握有关计算公式的运用和对概念的理解。
【解析】(1)根据反应的方程式为:N2+3H2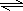 2NH3,生成1mol NH3,则消耗N2的物质的量0.5mol,所以2 min时,N2的物质的量等于2mol-0.5mol=1.5mol;
2NH3,生成1mol NH3,则消耗N2的物质的量0.5mol,所以2 min时,N2的物质的量等于2mol-0.5mol=1.5mol;
(2)根据反应的方程式为:N2+3H2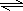 2NH3,生成1mol NH3,则消耗H2的物质的量是1.5mol,所以剩余H2的物质的量是1.5mol,所以此时
2NH3,生成1mol NH3,则消耗H2的物质的量是1.5mol,所以剩余H2的物质的量是1.5mol,所以此时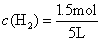 =0.3mol/L;
=0.3mol/L;
(3)2 min时,消耗H2的物质的量是1.5mol,所以H2的转化率是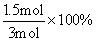 =50%;
=50%;
(4)根据反应的方程式为:N2+3H2 2NH3,生成1mol NH3,则消耗N2的物质的量0.5mol,即N2的浓度变化量
2NH3,生成1mol NH3,则消耗N2的物质的量0.5mol,即N2的浓度变化量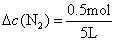 =0.1mol/L,所以
=0.1mol/L,所以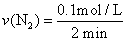 =0.05mol/(L· min);
=0.05mol/(L· min);
(5)N2、H2、NH3的反应速率之比等于化学计量数之比,即1:3:2。
【答案】1.5mol 0.3mol/L 50% 0.05mol/(L· min) 1:3:2


科目:高中化学 来源: 题型:
下表是元素周期表的一部分,回答下列有关问题:
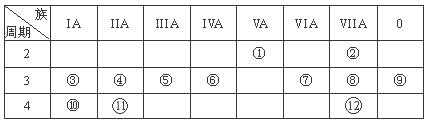
(1)写出下列元素符号:① ,⑥ ,⑦ 。
(2)画出原子的结构示意图:④ ,⑧ 。
(3)在①~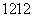 元素中,金属性最强的元素是 ,非金属性最强的元素是 ,最不活泼的元素是 。(均填元素符号)
元素中,金属性最强的元素是 ,非金属性最强的元素是 ,最不活泼的元素是 。(均填元素符号)
(4)元素⑦与元素⑧相比,非金属性较强的是 (用元素符号表示),下列表述中能证明这一事实的是 。
a.常温下⑦的单质和⑧的单质状态不同
b.⑧的氢化物比⑦的氢化物稳定
c.一定条件下⑦和⑧的单质都能与氢氧化钠溶液反应
(5)第三周期中原子半径最大的元素是 (用元素符号表示),跟它同周期的ⅦA元素是 (用元素符号表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
根据下图,可判断出下列离子方程式中错误的是( )

A.2Ag(s)+Cd2+(aq)===2Ag+(aq)+Cd(s)
B .Co2+(aq)+Cd(s)===Co(s)+Cd2+(aq)
.Co2+(aq)+Cd(s)===Co(s)+Cd2+(aq)
C.2Ag+(aq)+Cd(s)===2Ag(s)+Cd2+(aq)
D.2Ag+(aq)+Co(s)===2Ag(s)+Co2+(aq)
查看答案和解析>>
科目:高中化学 来源: 题型:
元素Y的原子获得3个电子或元素X的原子失去2个电子后,它们的电子层结构与氖原子的电子层结构相同,X、Y两种元素的单质在高温下得到的化合物的正确化学式是
A.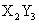 B.
B. C.
C.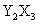 D.
D.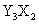
查看答案和解析>>
科目:高中化学 来源: 题型:
关于下列各装置图的叙述中,不正确的是
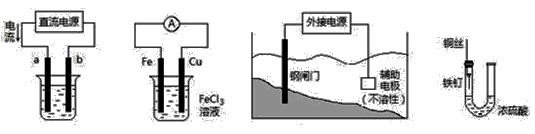
① ② ③ ④
A.用装置①精炼铜,则a极为粗铜,电解质溶液为CuSO4溶液
B.装置②的总反应是:Cu+2Fe3+= Cu2++2Fe2+
C.装置③中钢闸门应与外接电源的负极相连
D.装置④中的铁钉几乎没被腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关物质用途的说法中,正确的是
A.二氧化硅可用作半导体材料
B.硝酸常用作金属铜加工前的酸洗
C.碳酸钠可用于治疗胃酸过多
D.三氧化二铁常用于生产红色油漆和涂料
查看答案和解析>>
科目:高中化学 来源: 题型:
短周期元素R、Q、M、T在元素周期表中的相对位置如下表,已知R原子最外层电子数与次外层电子数之比为2:1。
 (1)人的汗液中台有T的简单离子,其离子结构示意图为__________; 元素M在元素周期表中的位置是_____________。
(1)人的汗液中台有T的简单离子,其离子结构示意图为__________; 元素M在元素周期表中的位置是_____________。
(2)R的最高价氧化物所含的化学键类型是__________键(选填“离子”或“共价”)。
(3)加热时,Q的最高价氧化物对应水化物的浓溶液与单质R反应的化学方程式为_________________________________(用具体的化学式表示)。
(4)在一定条件下甲、乙、丙有如下转化:甲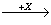 乙
乙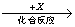 丙,若其中甲是单质,乙、丙为化合物,x是具有氧化性的无色气体单质,则甲的化学组成不可能是________________(选填序号,下同)。
丙,若其中甲是单质,乙、丙为化合物,x是具有氧化性的无色气体单质,则甲的化学组成不可能是________________(选填序号,下同)。
①R ②Q2 ③M ④T2
(5)元素T的含氧酸HTO具有漂白性。往20mL 0.0lmol·L-l的HTO溶液中逐滴加入一定浓度的烧碱溶液,测得混合溶液的温度变化如下图所示。据此判断:该烧碱溶液的浓度为______________mol·L-l;下列有关说法正确的是_______________。
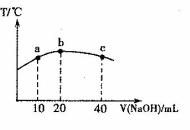 ①HTO的电离平衡常数:b点>a点
①HTO的电离平衡常数:b点>a点
②由水电离出的c(OH—):b点<c点
③从a点到b点,混合溶液中可能存在:
c(TO—)== c(Na+)
④从b点到c点,混合溶液中一直存在:
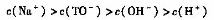
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于铝的叙述中正确的是
A.铝还原性强且亲氧性强,所以可通过铝热反应冶炼高熔点金属
B.铝在空气中极易锈蚀,所以铝制品的使用时间很短
C.铝能耐稀硫酸腐蚀,所以运送稀硫酸可用铝制槽车
D.铝的导电性比铜、银更强,所以常用以制造电线、电缆
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com