
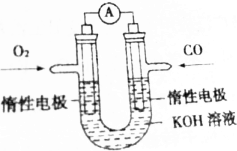
 某实验小组将反应2CO(g)+O2(g)═2CO2(g)设计成如图所示的电池装置,负极的电极反应式为CO-2e-+2OH-=CO32-+H2O;正极的电极反应式为O2+2H2O+4e-=4OH-.电池工作时,正极区域溶液的pH变大(填“变大”“变小”或“不变”)用该原电池做电源,电解200mL饱和食盐水(足量),消耗的标准状况下的CO224mL,则溶液的pH=13.(不考虑溶液体积的变化)
某实验小组将反应2CO(g)+O2(g)═2CO2(g)设计成如图所示的电池装置,负极的电极反应式为CO-2e-+2OH-=CO32-+H2O;正极的电极反应式为O2+2H2O+4e-=4OH-.电池工作时,正极区域溶液的pH变大(填“变大”“变小”或“不变”)用该原电池做电源,电解200mL饱和食盐水(足量),消耗的标准状况下的CO224mL,则溶液的pH=13.(不考虑溶液体积的变化) 分析 CO在负极失电子生成碳酸根离子,氧气在正极得电子生成氢氧根离子;根据电极方程式判断溶液pH的变化;电解饱和食盐水的离子方程式为:2Cl-+2H2O=H2↑+Cl2↑+2OH-,根据转移电子守恒计算溶液中的氢氧根离子浓度,再确定pH.
解答 解:将反应2CO(g)+O2(g)═2CO2(g)设计成如图所示的电池装置,CO在负极失电子生成碳酸根离子,则负极的电极方程式为:CO-2e-+2OH-=CO32-+H2O,氧气在正极得电子生成氢氧根离子,则正极的电极方程式为:O2+2H2O+4e-=4OH-;电池工作时,正极上氧气得电子生成氢氧根离子,所以正极区域溶液的pH变大;消耗的标准状况下的CO24mL,则CO的物质的量为$\frac{0.224L}{22.4L/mol}$=0.01mol,则转移电子为0.02mol,电解饱和食盐水的离子方程式为:2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$H2↑+Cl2↑+2OH-,由转移电子守恒可知,生成的氢氧根离子的物质的量为0.02mol,则c(OH-)=0.1mol/L,所以pH=13.
故答案为:CO-2e-+2OH-=CO32-+H2O;O2+2H2O+4e-=4OH-;变大;13.
点评 本题考查原电池、电解池工作原理,题目难度中等,正确推断燃料电池正负极是解本题的关键,难点是溶液的pH计算,根据电解饱和食盐水的离子方程式分析解答.


科目:高中化学 来源: 题型:选择题
| A. | ①>②>③>④ | B. | ①>②>④>③ | C. | ③>④>②>① | D. | ①=②=③=④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓盐酸在反应中仅体现还原性 | |
| B. | 被氧化和被还原的物质的物质的量之比为1:1 | |
| C. | 每生成0.1molClO2转移0.2mol电子 | |
| D. | 氧化性:NaClO3<Cl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某元素由化合态变为游离态时,该元素一定被还原 | |
| B. | 金属阳离子被还原不一定得到金属单质 | |
| C. | 生成非金属单质的反应一定是氧化反应 | |
| D. | 在氧化还原反应中,非金属单质一定是氧化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含SO2的烟气可用石灰乳吸收后再排放,以减少对空气污染 | |
| B. | 汽车尾气、工业排放、建筑扬尘、垃圾焚烧等都是造成雾霾天气的主要原因 | |
| C. | 绿色化学的核心是对环境产生的污染进行治理 | |
| D. | PM2.5由于颗粒小,在空气中存在时间长,对人体健康危害大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀硝酸与足量的Fe反应的离子方程式:3Fe+8H++2NO3-═3Fe2++2NO↑+4H2O | |
| B. | 碳酸氢钙溶液中加入过量的氢氧化钠:Ca2++HCO3-+OH-═CaCO3↓+H2O | |
| C. | 向碳酸钙中加入稀盐酸的离子方程式:CO32-+2H+═CO2↑+H2O | |
| D. | 硅酸钠溶液中通入过量二氧化碳:CO2+SiO32-+H2O═H4SiO4↓+CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com