
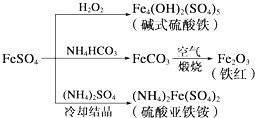
| A. | 制备碱式硫酸铁利用了过氧化氢的氧化性 | |
| B. | 为防止NH4HCO3分解,生产FeCO3需在较低温度下进行 | |
| C. | 可用KSCN溶液检验(NH4)2Fe(SO4)2是否被氧化 | |
| D. | 制备(NH4)2Fe(SO4)2利用了它的溶解度比FeSO4的溶解度大这一性质 |
分析 A.根据Fe3+能发生水解生成Fe(OH)3胶体,Fe(OH)3胶体具有吸附性,可用作净水剂;
B.根据NH4HCO3不稳定,受热易分解;
C.KSCN溶液遇Fe2+溶液无现象,遇Fe3+溶液变红;
D.根据溶解度大的沉淀可以转化为溶解度小的沉淀.
解答 解:A.碱式硫酸铁电离产生Fe3+,Fe3+,能发生水解生成Fe(OH)3胶体,Fe(OH)3胶体具有吸附性,可用作净水剂,故A正确;
B.NH4HCO3不稳定,受热易分解,所以为防止NH4HCO3分解,生产FeCO3需在较低温度下进行,故B正确;
C.KSCN溶液遇Fe2+溶液无现象,(NH4)2Fe(SO4)2若被氧化则生成Fe3+,KSCN溶液遇Fe3+溶液变红,故C正确;
D.(NH4)2Fe(SO4)2在水中的溶解度比FeSO4的小,所以FeSO4才能与(NH4)2SO4反应生成(NH4)2Fe(SO4)2,故D错误;故选D.
点评 本题以硫酸亚铁为原料进行物质的制备,主要考查了物质的性质与反应原理,难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知实验室制备1,2-二溴乙烷可能存在的主要副反应有:乙醇在浓硫酸的存在下在l40℃脱水生成乙醚.
已知实验室制备1,2-二溴乙烷可能存在的主要副反应有:乙醇在浓硫酸的存在下在l40℃脱水生成乙醚.| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | 一l30 | 9 | -1l6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
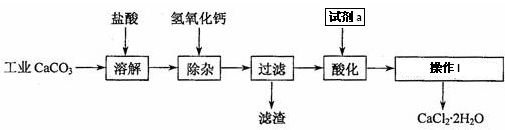
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
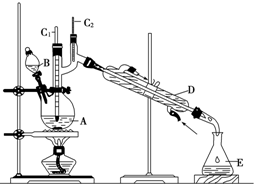 正丁醛是一种化工原料.某实验小组利用如右装置合成正丁醛.
正丁醛是一种化工原料.某实验小组利用如右装置合成正丁醛.| 沸点/℃ | 密度/(g•cm-3) | 水中溶解性 | |
| 正丁醇 | 117.2 | 0.810 9 | 微溶 |
| 正丁醛 | 75.7 | 0.801 7 | 微溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 高效利用CO2是“低碳经济”的有效途径,现有以下两种利用CO2的方法.
高效利用CO2是“低碳经济”的有效途径,现有以下两种利用CO2的方法.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com