
【题目】锌—空气燃料电池有比能量高、容量大、使用寿命长等优点,可用作电动车动力电源,电池的电解质溶液为 KOH 溶液,放电时发生反应:2Zn + O2+4OH-+2H2O= 2[Zn(OH)4]2-。下列说法正确的是:

A.放电时,负极反应为 Zn-2e- = Zn2+
B.该隔膜为阳离子交换膜,允许K+通过
C.充电时,当 0.1 molO2 生成时,流经电解质溶液的电子个数约为 1.204×1022
D.采用多孔炭可提高电极与电解质溶液的接触面积,并有利于氧气扩散至电极表面
【答案】D
【解析】
由放电时总反应2Zn + O2+4OH-+2H2O=2[Zn(OH)4]2-和装置图可知,金属Zn为负极,放电时发生反应:Zn +4OH--2e-=[Zn(OH)4]2-,多孔碳为正极反生反应:O2+4e-+2H2O=4OH-,充电时总反应为[Zn(OH)4]2-=2Zn + O2↑+4OH-+2H2O,金属Zn为阴极,多孔碳为阳极,以此分析。
A. 放电时,负极反应为Zn +4OH--2e-=[Zn(OH)4]2-,A项错误;
B. 正极反生反应:O2+4e-+2H2O=4OH-,可知该隔膜为阴离子交换膜,允许OH-通过,B项错误;
C. 不论放电还是充电,电子不会流经电解质溶液,C项错误;
D. 采用多孔炭可提高电极与电解质溶液的接触面积,并有利于氧气扩散至电极表面,D项正确;
答案选D。


科目:高中化学 来源: 题型:
【题目】银铜合金广泛用于航空工业。从切割废料中回收银并制备铜化工产品的工艺如下:
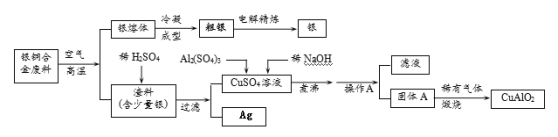
(注:Al(OH)3和Cu(OH)2受热易分解成对应的氧化物,且开始分解的温度分别为450℃和80℃)
(1)写出渣料与稀硫酸反应的化学方程式:________________________。
(2)固体混合物A的组成为 、 。
(3)操作A的名称为_______________。
(4)若银铜合金中铜的质量分数为64%,理论上5.0 kg废料中的铜可完全转化为 mol CuAlO2,至少需要1.0 molL—1的Al2(SO4)3溶液 L。
(5)CuSO4溶液也可用于制备胆矾晶体,其基本操作是 、 、过滤、干燥。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A,B,C,D,E均为有机化合物,A是分子式为C5H10O的直链化合物,B与NaHCO3溶液完全反应,其物质的量之比为1:2,它们之间的关系如图所示(提示:RCH=CHR′在酸性高锰酸钾溶液中反应生成RCOOH和R′COOH,其中R和R′为烷基).下列叙述错误的是( )

A.B的结构简式为HOOCCH2COOHB.C与乙醇发生了酯化反应
C.A可以与氢氧化钠溶液发生中和反应D.E的分子式为C3H2O4Na2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】5﹣二甲氧基苯酚是重要的有机合成中间体,可用于天然物质白柠檬素的合成,一种以间苯三酚为原料的合成反应如下:

甲醇、乙醚和3,5﹣二甲氧基苯酚的部分物理性质见下表:
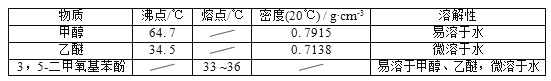
(1)反应结束后,先分离出甲醇,再加入乙醚进行萃取,①分离出甲醇的操作是的______;②萃取用到的分液漏斗使用前需__________________并洗净,分液时有机层在分液漏斗的________填(“上”或“下”)层;
(2)分离得到的有机层依次用饱和NaHCO3溶液、饱和食盐水、少量蒸馏水进行洗涤.用饱和NaHCO3溶液洗涤的目的是__,用饱和食盐水洗涤的目的是______;
(3)洗涤完成后,通过以下操作分离、提纯产物,正确的操作顺序是__(填字母);
a.蒸馏除去乙醚 b.重结晶 c.过滤除去干燥剂 d.加入无水CaCl2干燥
(4)固液分离常采用减压过滤.为了防止倒吸,减压过滤完成后应先________________,再______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在体积为V L的恒容密闭容器中盛有一定量H2,通入Br2(g)发生反应H2(g)+Br2(g)![]() 2HBr(g);ΔH<0。当温度分别为T1、T2,平衡时,H2的体积分数与Br2(g)的物质的量变化关系如图所示。下列说法正确的是
2HBr(g);ΔH<0。当温度分别为T1、T2,平衡时,H2的体积分数与Br2(g)的物质的量变化关系如图所示。下列说法正确的是
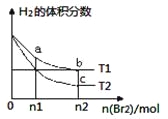
A. 若b、c点的平衡常数分别为K1、K2,则K1>K2
B. a、b两点的反应速率:b>a
C. 为了提高Br2(g)的转化率,可采取增加Br2(g)通入量的方法
D. 若平衡后保持温度不变,压缩容器体积平衡一定不移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W 是原子序数依次增大的短周期主族元素, 且 X、Z 原子序数之和是 Y、W 原子序数之和的![]() 。甲、乙 、丙、丁是由这些元素组成的二元化合物, M 是某种元素对应的单质, 乙和丁的组成元素相同, 且乙是一种“绿色氧化剂”, 化合物 N 是具有漂白性的气体(常温下)。上述质物间的转化关系如图所示(部分反应物和生成物省略)。下列说法正确的是:
。甲、乙 、丙、丁是由这些元素组成的二元化合物, M 是某种元素对应的单质, 乙和丁的组成元素相同, 且乙是一种“绿色氧化剂”, 化合物 N 是具有漂白性的气体(常温下)。上述质物间的转化关系如图所示(部分反应物和生成物省略)。下列说法正确的是:

A.沸点:丁>丙,热稳定性:丁>丙
B.原子半径: r(Y) > r(Z) > r(W)
C.Z 与 X、Y、W 形成的化合物中,各元素均满足 8 电子结构
D.化合物N 与乙烯均能使溴水褪色, 且原理相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2 L的恒容容器中,充入1 mol A和3 mol B,并在一定条件下发生如下反应:A(s)+3B(g)![]() 2C(g),若经3 s后测得C的浓度为0.6 mol·L-1,下列选项说法正确的组合是( )
2C(g),若经3 s后测得C的浓度为0.6 mol·L-1,下列选项说法正确的组合是( )
①用B表示的反应速率为0.4 mol·L-1·s-1
②3 s时生成C的物质的量为1.2 mol
③3 s时B的浓度为0.6 mol·L-1
A. ①②B. ①③
C. ②③D. ①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】相同温度下,容积均恒为2L的甲、乙、丙3个密闭容器中发生反应:2SO2(g)+O2(g)![]() 2SO3(g); △H=-197kJ·mol-l。 实验测得起始、平衡时的有关数据如下表:
2SO3(g); △H=-197kJ·mol-l。 实验测得起始、平衡时的有关数据如下表:
容器 | 起始各物质的物质的量/mol | 达到平衡时体系能量的变化 | |||
SO2 | O2 | SO3 | Ar | ||
甲 | 2 | 1 | 0 | 0 | 放出热量:Q1 |
乙 | 1.8 | 0.9 | 0.2 | 0 | 放出热量:Q2=78.8kJ |
丙 | 1.8 | 0.9 | 0.2 | 0.1 | 放出热量:Q3 |
下列叙述正确的是( )
A.Q1>Q3>Q2 =78.8kJ
B.三个容器中反应的平衡常数均为K=2
C.甲中反应达到平衡时,若升高温度,则SO2的转化率将大于50%
D.若乙容器中的反应经tmin达到平衡,则0~tmin内,v(O2)=1/5t mol/(L·min)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关碳酸钠、碳酸氢钠的说法正确的是

A.25℃时,碳酸氢钠在水中的溶解度比碳酸钠大
B.可用澄清石灰水鉴别碳酸钠溶液和碳酸氢钠溶液
C.可用如图所示装置比较Na2CO3和 NaHCO3的热稳定性
D.常温下,浓度均为0.1mol·L![]() 时的pH:NaHCO3 > Na2CO3
时的pH:NaHCO3 > Na2CO3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com