
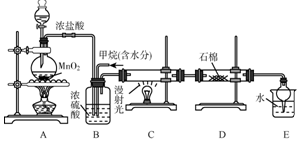
 利用甲烷与氯气发生取代反应制取副产品盐酸的设想在工业上已成为现实.某化学兴趣小组在实验室中模拟上述过程,其设计的模拟装置如图:
利用甲烷与氯气发生取代反应制取副产品盐酸的设想在工业上已成为现实.某化学兴趣小组在实验室中模拟上述过程,其设计的模拟装置如图:分析 (1)浓硫酸可以干燥氯气和氯化氢;
(2)甲烷可以和氯气发生取代反应,产物为氯化氢和二氯甲烷、三氯甲烷和四氯化碳;
(3)氯气能将碘化钾氧化为碘单质;能够氧化碘离子生成单质碘;
(4)装置中最后剩余的氯化氢气体需要吸收不能排放到空气中,氯化氢易溶于水需要防止倒吸;
(5)最后生成的HCl溶于水生成盐酸,与有机物可用分液的方法分离;一氯甲烷是气体,还可能有过量的甲烷.
解答 解:(1)生成的氯气中含有水,B装置除具有控制气流速度、均匀混合气体外,因浓硫酸具有吸水性,还具有干燥作用,故答案为:均匀混合气体,干燥气体;
(2)氯气与甲烷发生取代反应,反应特点是1mol氯气可取代1molH原子生成1molHCl,设$\frac{V(C{l}_{2})}{V(C{H}_{4})}$=x,若理论上欲获得最多的氯化氢,则x值应保证甲烷被完全取代,x应大于或等于4,故答案为:≥4;
(3)氯气具有氧化性,KI中-1价的碘能被氯气氧化,产物为氯化钾固体和碘单质,所以,D装置的石棉中均匀混有KI粉末,能吸收过量的氯气,故答案为:吸收过量的氯气;能够氧化碘离子生成单质碘;
故答案为:能吸收过量的氯气;Cl2+2I-=2Cl-+I2
(4)装置中最后剩余的氯化氢气体需要吸收不能排放到空气中,氯化氢易溶于水需要防止倒吸;
故答案为:CD.
(5)E装置中除了有盐酸生成外,还含有二氯甲烷、三氯甲烷和四氯化碳,二氯甲烷、三氯甲烷和四氯化碳不溶于水,能分层,可用分液分开;反应生成的二氯甲烷、三氯甲烷、四氯化碳均是油状的液体,只有一氯甲烷是气体,还可能有过量的甲烷,可能存在剩余的甲烷和生成的一氯甲烷等气体,应进行尾气处理,
故答案为:分液;AB.
点评 本题考查氯气的制备以及甲烷与氯气的取代反应,题目难度中等,本题注意把握题给信息,易错点为(5),注意把握产物的判断.


 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案科目:高中化学 来源: 题型:解答题
| 反应时间(min) | 1 | 2 | 3 | 4 | 5 |
| 生成氢气体积(ml) | 50 | 150 | 300 | 380 | 410 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
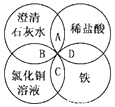 铁、稀硫酸、Ba(OH)2溶液、CuSO4溶液是中学化学常见的物质,这四种物质间的反应关系如图所示,图中两圆相交部分(A、B、C、D)表示物质之间可能发生的反应,请回答下列问题:
铁、稀硫酸、Ba(OH)2溶液、CuSO4溶液是中学化学常见的物质,这四种物质间的反应关系如图所示,图中两圆相交部分(A、B、C、D)表示物质之间可能发生的反应,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 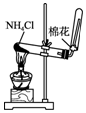 制备氨气 | B. | 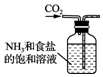 制取NaHCO3 | C. | 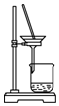 分离NaHCO3 | D. | 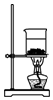 灼烧NaHCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸型酸雨的形成涉及反应:2H2SO3+O2$\frac{\underline{\;催化剂\;}}{\;}$2H2SO4 | |
| B. | SO2的水溶液显酸性:SO2+H2O?H2SO3?2H++SO32- | |
| C. | 常温下,0.1mol/L醋酸溶液pH≈3:CH3COOH?CH3COO-+H+ | |
| D. | Mg(OH)2固体在溶液中存在平衡:Mg(OH)2(s)?Mg2+(aq)+2OH-(aq),该固体可溶于NH4Cl溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com