
【题目】下列溶液中c(Cl-)最大的是
A. 65mL1mol/L的KCl溶液 B. 25mL3mol/L的NaCl溶液
C. 20mL2mol/L的MgCl2溶液 D. 10mL1.5mol/L的AlCl3溶液
 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案科目:高中化学 来源: 题型:
【题目】苯的同系物中,有的侧链能被KMnO4酸性溶液氧化,生成芳香酸,反应如下:
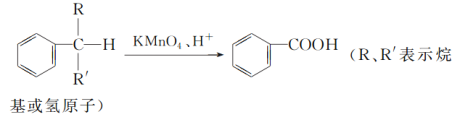
(1)现有苯的同系物甲、乙,分子式都是C10H14,甲不能被KMnO4酸性溶液氧化为芳香酸,它的结构简式是______________;乙能被KMnO4酸性溶液氧化为分子式为C8H6O4的芳香酸,则乙可能的结构有________种。
(2)有机物丙也是苯的同系物,分子式也是C10H14,它的苯环上的一溴代物只有一种,试写出丙所有可能的结构简式:__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化工厂生产的某产品A只含C、H、O三种元素,其分子模型如图所示(图中球与球之间的连线代表化学键,如单键、双键等). 
(1)该产品的结构简式为 , 含有的官能团名称 ,
(2)该化合物的核磁共振氢谱中有个吸收峰.
(3)(填序号)下列物质中,与A互为同分异构体的是 , 与A互为同系物的是 ①CH3CH=CHCOOH ②CH2=CHCOOCH3
③CH3CH2CH=CHCOOH ④CH3CH(CH3)COOH
(4)写出该物质与甲醇反应的化学方程式: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图中甲和乙均是双液原电池装置。判断下列说法不正确的是( )
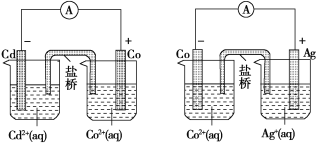
甲 乙
A.甲中电池总反应的离子方程式为Cd(s)+Co2+(aq)===Co(s)+Cd2+(aq)
B.反应2Ag(s)+Cd2+(aq)===Cd(s)+2Ag+(aq)能够发生
C.盐桥的作用是形成闭合回路,并使两边溶液保持电中性
D.乙电池中有1 mol电子通过外电路时,正极有108 g Ag析出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有甲、乙两个装置,下列说法错误的是
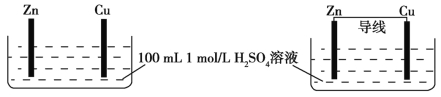
甲 乙
A.甲、乙装置中,Zn的质量均减小
B.甲、乙装置中,Cu上均有气泡产生
C.化学反应速率:乙>甲
D.甲装置中H+移向Zn,乙装置中H+移向Cu
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某探究活动小组想利用原电池反应检测金属的活动性顺序,有甲、乙两位同学均使用镁片与铝片作电极,但甲同学将电极放入6 mol·L-1的稀H2SO4中,乙同学将电极放入6 mol·L-1的NaOH溶液中,如图所示。
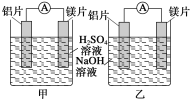
(1)写出甲池中发生的有关电极反应的反应式:
负极___________________________________,
正极___________________________________。
(2)写出乙池中发生的有关电极反应的反应式:
负极___________________________________,
正极___________________________________。
总反应离子方程式为_________________________。
(3)如果甲与乙两位同学均认为“构成原电池的电极材料若是金属,则构成负极材料的金属应比构成正极材料的金属活泼”,则甲会判断出________活动性更强,而乙会判断出________活动性更强(填写元素符号)。
(4)由此实验,可得到如下哪些结论?________。
A.利用原电池反应判断金属活动性顺序应注意选择合适的介质
B.镁的金属性不一定比铝的金属性强
C.该实验说明金属活动性顺序表已过时,已没有实用价值
D.该实验说明化学研究对象复杂、反应条件多变,应具体问题具体分析
(5)上述实验也反过来证明了“利用金属活动性顺序表直接判断原电池中正、负极”的做法________(填“可靠”或“不可靠”)。如不可靠,则请你提出另一个判断原电池正、负极可行的实验方案____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷能形成多种含氧酸.
(1)次磷酸(H3PO2)是一种精细化工产品,向10mL H3PO2溶液中加入20mL等物质的量浓度的NaOH溶液后,所得的溶液中只有H2PO2﹣、OH﹣两种阴离子.
①写出H3PO2溶液与足量NaOH 溶液反应后形成的正盐的化学式: , 该正盐溶液中各离子浓度由大到小的顺序为 .
②若25℃时,c(H3PO2)=1×10﹣2 , 则0.01molL﹣1的H3PO2溶液的pH=
(2)亚磷酸(H3PO3)是二元中强酸,25℃时亚磷酸的电离常数为K1=1×10﹣2、K2=2.6×10﹣7 .
①试从电离平衡移动的角度解释K1、K2数据的差异
②NaH2PO3溶液显性(填“酸”“碱”或“中”).
(3)25℃时,HF的电离常数为K=3.6×10﹣4; H3PO4的电离常数为K1=7.5×10﹣3 , K2=6.2×10﹣8 , K3=4.4×10﹣13 . 足量NaF溶液和H3PO4溶液反应的离子方程式为
(4)相同温度下,等物质的量浓度的上述三种磷的含氧酸中.c(H+)由大到小的顺序为(用酸的分子式表示).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室中配制碘水,往往是将I2溶于KI溶液中,这样就可以得到浓度较大的碘水,主要是因为发生了反应:I2(aq)+ I![]()
![]()
上述平衡体系中,![]() 的物质的量浓度c(
的物质的量浓度c(![]() )与温度T的关系如图所示(曲线上的任何一点都表示平衡状态):
)与温度T的关系如图所示(曲线上的任何一点都表示平衡状态):
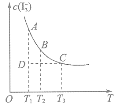
(1)通过分析上图,该反应的正反应为 反应(填“吸热”或“放热”)。
(2)在T1温度D状态时,v正 v逆(填“>”“<”或“=”);若在T1时某状态![]() =
=![]() , 平衡状态(填“是”“不是”或“不一定是”)。
, 平衡状态(填“是”“不是”或“不一定是”)。
(3)写出该平衡常数的表达式K = 。若升高温度,K值将 (填“增大”或“减小”或“不变”,下同);若向溶液中加入少量的溴水,K值将 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com