


 教学练新同步练习系列答案
教学练新同步练习系列答案 课前课后同步练习系列答案
课前课后同步练习系列答案 课堂小作业系列答案
课堂小作业系列答案科目:高中化学 来源: 题型:
| A、染发剂一般都具有一定的刺激性,使用时要注意安全 |
| B、烫发是一种不可逆转的化学过程,一旦烫发后,就不能再将卷曲的头发烫直,因此要“三思而烫” |
| C、药物牙膏具有预防和治疗口腔疾病的功能,但是由于刷牙时牙膏在口腔内停留时间很短且药物浓度较低,因此在预防和治疗口腔疾病时不能把希望寄托在各种药物牙膏上,有牙病应当及时到医院进行治疗 |
| D、所有的化妆品都有保质期,过期的化妆品对人体健康会产生危害 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、原子半径:C<B |
| B、元素A、C的氧化物均为共价化合物 |
| C、金属性:D>C |
| D、元素B、C、D的最高价氧化物对应水化物能相互反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
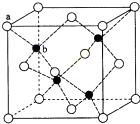 CuSO4在活化闪锌矿(主要成分是ZnS)方面有重要作用,主要是活化过程中生成CuS、Cu2S等一系列铜的硫化物活化组分.
CuSO4在活化闪锌矿(主要成分是ZnS)方面有重要作用,主要是活化过程中生成CuS、Cu2S等一系列铜的硫化物活化组分.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
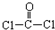 ,每个COCl2分子内含有
,每个COCl2分子内含有
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、利用太阳能制氢 |
| B、用家用汽车代替公交车 |
| C、利用化石燃料制造燃料电池 |
| D、用节能灯代替白炽灯 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com