
¶ŌČČ»Æѧ·½³ĢŹ½C(s)£«H2O(g)===CO(g)£«H2(g)””¦¤H£½£«131.3 kJ·mol£1×ī×¼Č·µÄĄķ½āŹĒ (””””)
A£®Ģ¼ŗĶĖ®·“Ó¦ĪüŹÕ131.3 kJČČĮæ
B£®1 molĢ¼ŗĶ1 molĖ®·“Ӧɜ³ÉŅ»Ńõ»ÆĢ¼ŗĶĒāĘų£¬Ķ¬Ź±·Å³ö131.3 kJČČĮæ
C£®1 molĢ¼ŗĶ1 molĖ®ÕōĘų·“Ӧɜ³É1 mol COŗĶ1 mol H2£¬Ķ¬Ź±ĪüŹÕ131.3 kJČČĮæ
D£®1øö¹ĢĢ¬Ģ¼Ō×ÓŗĶ1·Ö×ÓĖ®ÕōĘų·“Ó¦ĪüČČ131.1 kJ
 ¾ŁŅ»·“ȿʌĩ°Ł·Ö³å“Ģ¾ķĻµĮŠ“š°ø
¾ŁŅ»·“ȿʌĩ°Ł·Ö³å“Ģ¾ķĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”°·ÖĄą”±ŹĒŅ»ÖÖĖ¼Ļė·½·Ø£¬ŌŚ»Æѧ·¢Õ¹ÖŠĘšµ½ĮĖÖŲŅŖµÄ×÷ÓĆ”£ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ ( )
A£®Ńõ»Æ»¹Ō·“Ó¦ÖŠ£¬Ņ»ÖÖŌŖĖŲ»ÆŗĻ¼ŪÉĻÉż£¬Ņ»¶ØÓŠĮķŅ»ÖÖŌŖĖŲ»ÆŗĻ¼ŪĻĀ½µ
B”¢øł¾Ż·ÖÉ¢ĻµŹĒ·ń¾ßÓŠĪČ¶ØŠŌ½«·ÖÉ¢Ļµ·ÖĪŖČÜŅŗ”¢½ŗĢåŗĶ×ĒŅŗ
C£®øł¾ŻĖ®ČÜŅŗÄÜ·ńµ¼µē½«»ÆŗĻĪļ·ÖĪŖµē½āÖŹŗĶ·Ēµē½āÖŹ
D£®¼īŠŌŃõ»ÆĪļŅ»¶ØŹĒ½šŹōŃõ»ÆĪļ£¬½šŹōŃõ»ÆĪļ²»Ņ»¶ØŹĒ¼īŠŌŃõ»ÆĪļ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
ĻĀĮŠ“ķĪó²Ł×÷ÖŠ£¬ÄÜŌģ³ÉÖŠŗĶµĪ¶Ø½į¹ūĘ«µĶµÄŹĒ(””””)
A£®Ī“ÓƱź×¼ŅŗČóĻ“µĪ¶Ø¹Ü
B£®Ź¢±ź×¼ŅŗµÄµĪ¶Ø¹Ü¼ā×ģ²æ·ÖÓŠĘųÅŻĪ“Åųż¾ĶæŖŹ¼µĪ¶Ø
C£®Ķł×¶ŠĪĘæÖŠ¼Ó“ż²āŅŗŹ±£¬×¶ŠĪĘæĻČÓĆ“ż²āŅŗČóĻ“
D£®Õńµ“Ź±×¶ŠĪĘæÖŠŅŗµĪ·É½¦³öĄ“
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
Ä³Ń§ÉśŹŌĶ¼ÓƵē½ā·Øøł¾Żµē¼«ÉĻĪö³öĪļÖŹµÄÖŹĮæĄ“ŃéÖ¤°¢·ü¼ÓµĀĀŽ³£ŹżÖµ£¬Ę䏵Ńé·½°øµÄŅŖµćĪŖ£ŗ

¢ŁÓƵēĮ÷µē½āĀČ»ÆĶČÜŅŗ£¬·“Ó¦ŅĒĘ÷ČēĶ¼
¢ŚŌŚµēĮ÷ĪŖI A£¬ĶصēŹ±¼äĪŖt sŗ󣬾«Č·²āµĆijµē¼«ÉĻĪö³öµÄĶµÄÖŹĮæĪŖm g”£ŹŌ»Ų“š£ŗ
(1)ÕāŠ©ŅĒĘ÷µÄÕżČ·Į¬½ÓĖ³ŠņĪŖ(ÓĆĶ¼ÖŠ±ź×¢ŅĒĘ÷½ÓĻßÖłµÄÓ¢ĪÄ×ÖÄø±ķŹ¾£¬ĻĀĶ¬)
E½Ó £¬ ½Ó £¬ ½ÓF”£ŹµŃéĻßĀ·ÖŠµÄµēĮ÷·½ĻņĪŖ____”ś____”ś____”ś____”ś____”ś____”£
(2)Š“³öBµē¼«ÉĻ·¢Éś·“Ó¦µÄĄė×Ó·½³ĢŹ½__________________________________
________________£¬GŹŌ¹ÜÖŠµķ·ŪKIČÜŅŗ±ä»ÆµÄĻÖĻóĪŖ________________£¬ĻąÓ¦µÄĄė×Ó·½³ĢŹ½ŹĒ____________________________________________________________”£
(3)ĪŖ¾«Č·²ā¶Øµē¼«ÉĻĪö³öĶµÄÖŹĮ棬Ėł±ŲŠčµÄŹµŃé²½ÖčµÄĻČŗóĖ³ŠņŹĒ______________”£
¢Ł³ĘĮæµē½āĒ°µē¼«ÖŹĮæ
¢Ś¹ĪĻĀµē½āŗóµē¼«ÉĻµÄĶ²¢ĒåĻ“
¢ŪÓĆÕōĮóĖ®ĒåĻ“µē½āŗóµē¼«
¢ÜµĶĪĀŗęøɵē¼«ŗó³ĘĮæ
¢ŻµĶĪĀŗęøɹĪĻĀµÄĶ²¢³ĘĮæ
¢ŽŌŁ“ĪµĶĪĀŗęøɹĪĻĀµÄĶ²¢³ĘĮæ
¢ßŌŁ“ĪµĶĪĀŗęøÉŗó³ĘĮæÖĮŗćÖŲ
(4)ŅŃÖŖµē×ӵĵēĮæĪŖ1.6”Į10£19æāĀŲ”£ŹŌĮŠ³ö°¢·ü¼ÓµĀĀŽ³£Źż¼ĘĖć±ķ“ļŹ½£ŗNA£½________________________________________________________________________”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
ĻĀĮŠŅĄ¾ŻČČ»Æѧ·½³ĢŹ½µĆ³öµÄ½įĀŪÕżČ·µÄŹĒ£Ø £©
A£®ŅŃÖŖNaOH(aq)£«HCl(aq)£½NaCl(aq)£«H2O(l) ”÷H£½£57.3 kJ·mol£1£¬Ōņŗ¬40.0 g NaOHµÄĻ”ČÜŅŗÓėĻ”“×ĖįĶźČ«ÖŠŗĶ£¬·Å³öŠ”ÓŚ57.3 kJµÄČČĮæ
B£®ŅŃÖŖ2H2(g)£«O2(g)£½2H2O(g) ”÷H£½£483.6 kJ·mol-£1£¬ŌņĒāĘųµÄČ¼ÉÕČČĪŖ241.8 kJ·mol£1
C£®ŅŃÖŖ2C(s)£«2O2(g)£½2CO2(g) ”÷H£½a”¢2C(s)£«O2(g)£½2CO(g) ”÷H£½b£¬Ōņa£¾b
D£®ŅŃÖŖP (°×Į×£¬s)£½P (ŗģĮ×£¬s) ”÷H£¼0£¬Ōņ°×Į×±ČŗģĮ×ĪȶØ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
ŅŃÖŖ»Æѧ¼üÄÜ£ŗSi—Si£ŗM KJ/mol O=O£ŗN KJ/mol Si—O£ŗQ KJ/mol£¬ŌņSi (s) + O2 (g) ==SiO2 (s); ¦¤H= £Ø £©
A£®—£Ø4Q—2M—N£©KJ/mol B£®—£Ø4Q—M—2N£©KJ/mol
C£®—£Ø2Q—M—2N£©KJ/mol D£®—£Ø2Q—2M—N£©KJ/mol
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
±ź×¼×“Ģ¬ĻĀ£¬ĘųĢ¬·Ö×Ó¶ĻæŖl mol»Æѧ¼üµÄģŹ±ä³ĘĪŖ¼üģŹ”£ŅŃÖŖH-H”¢H-O
ŗĶO-O¼üµÄ¼üģŹ¦¤H·Ö±šĪŖ436 kJ/mol”¢463 kJ/molŗĶ495kJ/mol”£ĻĀĮŠČČ»Æѧ·½³ĢŹ½ÕżČ·µÄŹĒ
A£®H2O (g)= H2(g)+ O2(g); ¦¤H= -485 kJ/mol
O2(g); ¦¤H= -485 kJ/mol
B£®H2O (g)=H2(g)+ O2(g); ¦¤H==+485 kJ/mol
O2(g); ¦¤H==+485 kJ/mol
C£®2H2(g)+ O2 (g)= 2H2O(g) ¦¤H = +485 kJ/mol
D£®2H2(g)+ O 2(g)=2H2O(g) ¦¤H = -485 kJ/mol
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
ĻĀĮŠĄė×Ó·½³ĢŹ½ÕżČ·µÄŹĒ(””””)
A£®Ģ¼ĖįµÄµēĄė£ŗH2CO3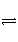
 2H£«£«CO
2H£«£«CO
B£®½«½šŹōÄĘ¼ÓČėĖ®ÖŠ£ŗ2Na£«2H2O===2Na£«£«2OH££«H2”ü
C£®Įņ»ÆÄĘĖ®½ā£ŗS2££«2H2O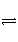
 H2S”ü£«2OH£
H2S”ü£«2OH£
D£®ĻņĀČ»ÆĀĮČÜŅŗÖŠ¼ÓČė¹żĮæµÄÉÕ¼īČÜŅŗ£ŗAl3£«£«3OH£===Al(OH)3”ż
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
ÅŠ¶ĻÕżĪó£¬ÕżČ·µÄ»®”°”Ģ”±£¬“ķĪóµÄ»®”°”Į”±
£Ø1£©(2012·½ĖÕ£¬7¢Ū)±„ŗĶNaCl(aq) NaHCO3
NaHCO3 Na2CO3 ( )
Na2CO3 ( )
£Ø2£©(2012·¹ć¶«Ąķ×Ū£¬10A)Na2O2ÓĆ×÷ŗōĪüĆę¾ßµÄ¹©Ńõ¼ĮÉę¼°Ńõ»Æ»¹Ō·“Ó¦ ( )
£Ø3£©(2012·ĖÄ“ØĄķ×Ū£¬9A)ÄĘÓėĖ®·“Ó¦£ŗNa£«2H2O===Na£«£«2OH££«H2”ü ( )
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com