
下列离子组一定能大量共存的是( )
A.常温下c(OH?)/c(H+)=1012的溶液中:NH4+、Al3+、NO3-、CO32-
B.滴加甲基橙试剂显红色的溶液中:Na+、Fe2+、Cl-、NO3-
C.常温下由水电离出来的c(H+)=1×10-13mol/L的溶液中:K+、CO32-、Cl-、NO3-
D.常温下,Kw/c(H+)=0.1 mol/L的溶液:Na+、K+、CO32-、NO3-
 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案科目:高中化学 来源:2016届宁夏固原一中高三上适应性训练理综化学试卷(解析版) 题型:实验题
亚氯酸钠(NaClO2)是重要漂白剂,探究小组开展如下实验,回答下列问题:
实验Ⅰ:制取NaClO2晶体按如下图装置进行制取。
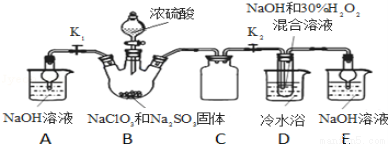
已知:NaClO2饱和溶液在低于38℃时析出NaClO2•3H2O,高于38℃时析出NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl。
(1)装置C的作用是 ;
(2)已知装置B中的产物有ClO2气体,则装置B中反应的方程式为 ;装置D中反应生成NaClO2的化学方程式为 ;反应后的溶液中阴离子除了ClO2﹣、ClO3﹣、Cl﹣、ClO﹣、OH﹣外还可能含有的一种阴离子是 ;检验该离子的方法是 ;
(3)如果撤去D中的冷水浴,可能导致产品中混有的杂质是 ;
实验Ⅱ:样品杂质分析与纯度测定
(4)测定样品中NaClO2的纯度.测定时进行如下实验:
①准确称取所得亚氯酸钠样品m g于烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应(已知:ClO2-+4I-+4H+=2H2O+2I2+Cl-);将所得混合液配成250 mL待测溶液。
②移取25.00 mL待测溶液于锥形瓶中,加几滴淀粉溶液,用c mol·L-1 Na2S2O3标准液滴定,至滴定终点。重复2次,测得平均值为V mL(已知:I2+2S2O32-=2I-+S4O62-)。
达到滴定终点时的现象为________________。该样品中NaClO2的质量分数为____________(用含m、c、V的代数式表示)。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年浙江省桐乡市高二上期中(普通班)化学试卷(解析版) 题型:选择题
下列对化学反应的认识正确的是
A.化学反应过程中,分子的种类和数目一定发生改变
B.如果某化学反应的△H和△S均小于0,则反应一定能自发进行
C.化学反应过程中,一定有化学键的断裂和形 成
成
D.所有的吸热反应一定要在加热的条件下才能进行
查看答案和解析>>
科目:高中化学 来源:2015-2016学年广西省高二上段考文化学试卷(解析版) 题型:选择题
下列关于1.5 mol 氢气的叙述中,正确的是
A.质量是 4 g B.体积是 33.6 L
C.电子数是 3 D.分子数是 1.5×6.02 ×1023 个
查看答案和解析>>
科目:高中化学 来源:2015-2016学年广西省高一上段考化学试卷(解析版) 题型:填空题
实验室可利用反应2KMnO4 + 16HCl=2KCl + 2MnCl2 + 5Cl2 ↑ + 8H2O制取氯气,请结合反应回答以下问题:
(1)用“单线桥法”表示反应中电子转移的方向和数目:
2KMnO4 + 16HCl=2KCl + 2MnCl2 + 5Cl2 + 8H2O
(2)该反应中,氧化剂是___________,氧化产物是_________,被氧化与未被氧化的HCl的物质的量之比为__________,若有7.3g HCl被氧化,则产生Cl2的质量为_____,转移的电子数为______。
查看答案和解析>>
科目:高中化学 来源:2015-2016年陕西西藏民族学院附属中学高二上期末化学卷(解析版) 题型:选择题
在给定的四种溶液中,加入以下各种离子,各离子能在原溶液中大量共存的是( )
A.滴加石蕊试液显红色的溶液:Fe3+、NH4+、Cl﹣、CH3COO-
B.pH值为1的溶液:Cu2+、Na+、Mg2+、NO3﹣
C.水电离出来的c(H+)=10﹣12mol/L的溶液:K+、HCO3﹣、Br﹣、Ba2+
D.所含溶质为Na2CO3的溶液:K+、Ca2+、NO3﹣、Al3+
查看答案和解析>>
科目:高中化学 来源:2016届黑龙江省高三上第三次检测理综化学试卷(解析版) 题型:填空题
铁的发现和大规模使用,是人类发展史上的一个光辉里程碑,它把人类从石器时代、青铜器时代带到了铁器时代,推动了人类文明的发展。
(1)高铁酸钠(Na2FeO4)是水处理过程中的一种新型净水剂,它的氧化性比高锰酸钾更强,本身在反应中被还原成三价铁离子达到净水的目的。按要求回答下列问题: 高铁酸钠主要通过如下反应制取:
2Fe(OH)3 + 3NaClO + 4NaOH = 2Na2FeO4 + 3X + 5H2O,
则X 的化学式________________ ,反应中被氧化的物质是_____________ (写化学式)。
(2)铁红颜料跟某些油料混合,可以制成防锈油漆。以黄铁矿为原料制硫酸产生的硫酸渣中含Fe2O3、SiO2、Al2O3、MgO 等,用硫酸渣制备铁红(Fe2O3)的过程如下:
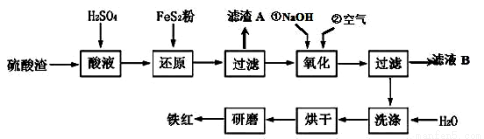
①酸溶过程中Fe2O3与稀硫酸反应的化学方程式为_______________________ ;
“滤渣A”主要成份的化学式为____________________ 。
②还原过程中加入FeS2的目的是将溶液中的Fe3+还原为Fe2+,而本身被氧化为H2SO4,请完成该反应的离子方程式:
___ FeS2 + ___Fe3 + +___ H2O = ___Fe2 + +___ SO42- + ___。
③氧化过程中,O2、NaOH与Fe2+反应的离子方程式为________________ 。
④为了确保铁红的质量和纯度,氧化过程需要调节溶液的pH的范围是3.2~3.8,
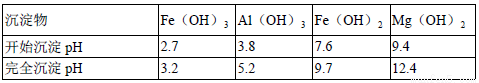
如果pH过大,可能引起的后果是____________(几种离子沉淀的pH见上表);滤液B可以回收的物质有___________(写化学式) 。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年广西柳州铁路一中高一上12月月考化学卷(解析版) 题型:选择题
下列有关说法不正确的是 ( )
A.常温下干燥的Cl2能用钢瓶贮运
B.检验HCl气体中是否混有Cl2,方法是将气体通入硝酸银溶液
C.自然界中不存在游离态硅
D.HF溶液不能贮存在磨口玻璃塞的试剂瓶中
查看答案和解析>>
科目:高中化学 来源:2016届陕西省高三上期末化学试卷(解析版) 题型:实验题
铝元素在自然界中主要存在于铝土矿(主要成分为Al2O3,还含有Fe2O3、FeO、SiO2)中,工业上用铝土矿制备铝的某种化合物的工艺流程如图1.
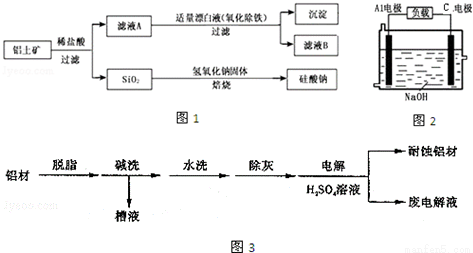
(1)在滤液A中加入漂白液,目的是氧化除铁,所得滤液B显酸性.
①检验滤液B中是否还含有铁元素的方法为______________________(注明试剂、现象);
②由滤液B制备氯化铝晶体涉及的操作为:边滴加浓盐酸边蒸发浓缩、___________ 、_________、洗涤;
(2)新型铝空气电池具有比能量大、质量轻、无毒和危险性等优点.Al电极易被NaOH溶液腐蚀,这是该电池目前未能推广使用的原因之一,电极被腐蚀的离子方程式为
(3)对金属制品进行抗腐蚀处理,可延长其使用寿命.图3为铝材表面处理的一种方法
①碱洗的目的是除去铝材表面的自然氧化膜,原理是___________________________(用离子方程式表示).为将碱洗槽液中铝元素以沉淀形式回收,最好向槽液中加入下列试剂中的___________
a.NH3 b.CO2 c.NaOH d.HNO3
②以铝材为阳极,在H2SO4 溶液中电解,铝材表面形成氧化膜,则阳极电极反应为______________;取少量废电解液,加入NaHCO3,溶液后产生气泡和白色沉淀,产生沉淀的原因是______________.(用离子方程式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com