
(14��)����̼ѭ��������������ҵĸ߶����ӣ�����ν��ʹ�����CO2�ĺ�������Ч�ؿ�������CO2����Ϊ��ѧ���о�����Ҫ���⡣
��1������ͬ����CO(g)��H2O(g)�ֱ�ͨ�뵽���Ϊ2 L�ĺ����ܱ������У����з�ӦCO(g)��H2O(g) CO2(g)��H2(g)���õ������������ݣ�
CO2(g)��H2(g)���õ������������ݣ�
ʵ���� | �¶ȡ� | ��ʼ��/mol | ƽ����/mol | �ﵽƽ������ | ||
CO | H2O | H2 | CO | |||
1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
3 | 900 | a | b | c | d | t |
��ʵ��2������ƽ�ⳣ��K= ��
��ʵ��3�У���ƽ��ʱ��CO��ת���ʴ���ˮ��������a/b ��ֵ_______(�����ֵ��ȡֵ��Χ)��
��ʵ��4����900 ��ʱ���ڴ������м���CO��H2O��CO2 ��H2��Ϊ1 mol�����ʱV�� V��(�����������������=��)��
��2����֪�ڳ��³�ѹ�£�
��2CH3OH(l)��3O2(g) �� 2CO2(g)��4H2O(g) ��H����1275.6 kJ��mol��1
��2CO (g)�� O2(g) �� 2CO2(g) ��H����566.0 kJ��mol��1
��H2O(g) �� H2O(l) ��H����44.0 kJ��mol��1
д���״�����ȫȼ������һ����̼��Һ̬ˮ���Ȼ�ѧ����ʽ��____________
��3����֪������һ�ֶ�Ԫ���ᣬ��������(NaHC2O4)��Һ�����ԡ������£���10 mL 0.01 mol��L��1 H2C2O4��Һ�еμ�10 mL 0.01 mol��L��1 NaOH��Һʱ���Ƚ���Һ�и�������Ũ�ȵĴ�С��ϵ ��
��4��CO2����Ȼ��ѭ��ʱ����CaCO3��Ӧ��CaCO3��һ���������ʣ���Ksp=2.8��10��9��CaCl2��Һ��Na2CO3��Һ��Ͽ��γ�CaCO3�������ֽ��������CaCl2��Һ��Na2CO3��Һ��ϣ���Na2CO3��Һ��Ũ��Ϊ2��10��4 mol��L��1�������ɳ�������CaCl2��Һ����СŨ��Ϊ ______________mol��L��1��
��5���Զ�����(CH3OCH3)��������H2SO4Ϊԭ�ϣ���Ϊ�缫�ɹ���ȼ�ϵ�أ��乤��ԭ�������ȼ�ϵ�ص�ԭ�����ơ���д���õ�ظ����ϵĵ缫��Ӧʽ�� ��
(14��)
��1����1/ 6��0.17 �ڣ�1 (��0��a/b��1���) �ۣ�
��2��CH3OH(l)�� O2(g) �� CO(g)��2H2O(l) ��H����442.8 kJ�Mmol
��3��c(Na��)��c(HC2O4�� )��c(H��)��c(C2O42��)��c(OH��)
��4��5.6��10��5
��5��CH3OCH3-12e����3H2O=3CO2��12H��
��������
�����������1����CO(g)��H2O(g) CO2(g)��H2(g)
CO2(g)��H2(g)
��ʼŨ�� 1 0.5 0 0
�仯Ũ�� 0.2 0.2 0.2 0.2
ƽ��Ũ�� 0.8 0.3 0.2 0.2
ʵ��2������ƽ�ⳣ��K=(0.2��0.2)��(0.3��0.8)=0.17
�ڰ�ϵ���ȼ������Ӧ���a=b������Ӧ���ת������ͬ�����ڿ��淴Ӧ�У�����ˮ������������CO��ת���ʣ�H2O��ת���ʽ��ͣ�������ƽ��ʱ��CO��ת���ʴ���ˮ��������a/b ��ֵС��1.
��2�����ݸ�˹���ɣ��١�2-�ڡ�2���ۡ�2=-442.8 kJmol��1�����Լ״�����ȫȼ������һ����̼��Һ̬ˮ���Ȼ�ѧ����ʽΪCH3OH(l)��O2(g)=CO(g)��2H2O(l) H=-442.8 kJmol��1��
��3�������£���10 mL 0.01 mol��L��1 H2C2O4��Һ�еμ�10 mL 0.01 mol��L��1 NaOH��Һ�������NaOHǡ��1:1��Ӧ���ɲ������ƣ�������������ǿ����ʣ���ȫ����������ӺͲ���������ӣ�������һ�ֶ�Ԫ���ᣬ��������(NaHC2O4)��Һ�����ԣ�˵������������ӵĵ���̶ȴ�����ˮ��̶ȣ�������Һ�и�������Ũ�ȵĴ�С��ϵΪc(Na��)��c(HC2O4�� )��c(H��)��c(C2O42��)��c(OH��)
��4��Na2CO3��Һ��Ũ��Ϊ2��10��4 mol��L��1�����������CaCl2��Һ��Na2CO3��Һ��Ϻ�c(CO32 ��)=1��10��4 mol��L��1������CaCO3 ����ʱ��c(Ca2��)��1��10��4 mol��L��1= Ksp=2.8��10��9�����c(Ca2��)= 2.8��10��5mol/L���������ɳ�������CaCl2��Һ����СŨ��Ϊ2��2.8��10��5=5.6��10��5mol/L
��5�� �Զ�����(CH3OCH3)��������H2SO4Ϊԭ�ϣ���Ϊ�缫�ɹ���ȼ�ϵ�أ��乤��ԭ�������ȼ�ϵ�ص�ԭ�����ƣ�����ʧ����������������CO2 ��ˮ���������ʧ����Ҳ������������CO2 ��ˮ���õ�ظ����ϵĵ缫��ӦʽΪCH3OCH3-12e����3H2O=3CO2��12H����
���㣺���黯ѧƽ�ⳣ���ļ��㣬�Ȼ�ѧ����ʽ����д������Ũ�ȵĴ�С�Ƚϣ������ܽ�ƽ���Ӧ�á�
��������� ����1����ѧ��Ӧ������ ����2���绯ѧ���� ����3����ѧƽ��״̬���ƶ� ��������

 ��Ȥ����¹�֪��ϵ�д�
��Ȥ����¹�֪��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2014-2015�Ϻ��и�һ��ѧ����ĩ���Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
NaF��NaI��MgO��Ϊ���ӻ���������������ݣ����ж����ֻ�������۵㡢�е�ߵ͵�˳����
���� | ��NaF | ��NaI | ��MgO |
���ӵ���� | 1 | 1 | 2 |
���ӵĺ˼�� | 23��1nm | 31��8nm | 21��0nm |
A����>��>�� B����>��>�� C����>��>�� D����>��>��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ���㽭ʡ�����ڶ���ģ�����ۻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
��ͼ��CO2�����ԭΪCH4�Ĺ���ԭ��ʾ��ͼ������˵������ȷ����
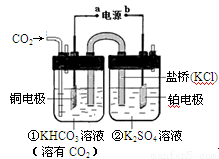
A���ù����ǵ���ת��Ϊ��ѧ�ܵĹ���
B��ͭ�缫�ĵ缫��ӦʽΪ��CO2��8H+��8e����CH4��2H2O
C��һ��ʱ��ٳ���n(KHCO3)����
D��һ��ʱ��ڳ�����Һ��pHһ���½�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ������ʡ������ѧ�ڳ��������ۻ�ѧ�Ծ��������棩 ���ͣ������
ͭ�ڹ�ũҵ���������Ź㷺����;��
��1������CuSO4��Һʱ���������ϡH2SO4����ԭ���� (ֻд���ӷ���ʽ)��
��2��ijͬѧ�����Ƶõ�CuSO4��Һ����������ʵ��̽����
��ͼ���Ǹ��ݷ�ӦFe��CuSO4=Cu��FeSO4��Ƶ�ԭ��أ�����ͼ���еĺ�������ɱ�ע��

��ͼ���У�I�Ǽ���ȼ�ϵ�ص�ʾ��ͼ����ͬѧ����II��ʵ�����϶�ͭ����Ӧ��a��ͨ�� (�CH4����O2��)��b���缫�Ϸ����ĵ缫��ӦʽΪ ��
����II�е缫����Ϊ���Ե缫�����Һ��Ϊ����0.1 mol NaCl��Һ400 mL������������������Ϊ448 mL(��״����)ʱ����Һ��pH= (������Һ����仯���Բ���)��
��3�����������ҵ��ˮ�г����ж���Cu2�����ؽ������ӣ�����FeS������������Ϊ��������ȥ[������Ksp(FeS)��6.3��10��18mol2��L��2��Ksp(CuS)��1.3��10��36mol2��L��2]���������ӷ���ʽ˵���������ӵ�ԭ��������FeS���빤ҵ��ˮ�к� ֱ��FeSȫ��ת��ΪCuS�������Ӷ���ȥ��Һ��Cu2����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ������ʡ������ѧ�ڳ��������ۻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
���й��ڰ���ӵ�������˵����ȷ����
A��0.1 NA��NO��һ�ܱ�������������������ȫ��Ӧ���õ�0.1 mol NO2
B��һ�������µ��ܱ������У�6.4 g SO2�ɱ����������õ�SO3�ķ�����Ϊ0.1 NA
C��������18 g����������Ũ������ת�Ƶ�����2 NA
D��1 L 0.1 mol/L FeCl3��Һ��ȫˮ��õ���Fe(OH)3��������С��0.1 NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ����������в����ظ�����ѧ�ڷ�У���п��Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
��������MO2��ĩͶ����ˮ�У�һ�߽��裬һ��ͨ��SO2���壬����õ���ɫ������X����֪X���������������ǻ�ԭ��������жϴ������
��MO2���������� �ڰ�ɫ������XΪMSO2
�۰�ɫ������XΪMSO4 �ܰ�ɫ������XΪMS��
A���٢� B���ۢ� C���ڢ� D���٢�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ����������в����ظ�����ѧ�ڷ�У���п��Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
����ѡ������һ�ֿ����մɡ���ͨ������ˮ���Ϊͬ�����͵IJ���
A�����Ͻ� B�����½ṹ�������մ�
C���л����� D��ש��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ��㶫ʡ��ͷ�и�����һ��ģ�⿼�����ۻ�ѧ�Ծ��������棩 ���ͣ�ʵ����
��16�֣��Ի�ͭ��Ϊ��Ҫԭ��������ͭ���������Ϻ����ʣ�ԭ�ϵ��ۺ������ʽϸߡ�����Ҫ�������£�

�ش��������⣺
��1���ӻ�ͭ��ұ����ͭ�Ĵ�ͳ�����ǽ���ѡ��ĸ�ͭ��ɰ������ڸ��������գ�ʹ��ת��Ϊͭ�����ַ�����ȱ����Ҫ���Ĵ����������Լ� ����ɺ�����һ�ּ��ɣ���
��2�����ˢ۵õ��������ɷ��� ���ѧʽ����
��3����Ӧ���У����� ����Ӧ������������ԭ��Ӧ��
��4����ҺA�к��е������� ���ѧʽ����
��5��д����Ӧ��Ļ�ѧ����ʽ ��
��6���ٷ�Ӧ����FeCO3�ڿ��������գ�д����ѧ����ʽ ��
�ڷ�Ӧ���з�����Ӧ�����ӷ���ʽ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ�긣��ʡ�����и���������⻯ѧ�Ծ��������棩 ���ͣ�ѡ����
2015�����绷�������������������Ⱦ�������ж�������������������ȷ����
A��Ϊ���ũ����IJ���������ʹ�û��ʺ�ũҩ
B����ɫ��ѧ�ĺ����ǶԻ�����Ⱦ��������
C��Ϊ��ֹʳƷ���ʣ���������ķ�����
D�������ǷŴ��ط�����Դ�����з�����մ���
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com