
| A、c(H+)+c(Na+)=c(HB-)+c(B2-)+c(OH-) |
| B、c(Na+)=0.1 moL/L≥c(B2-) |
| C、c(H+)×c(OH-)=1×10-14 |
| D、溶液的pH=1 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、福尔马林、葡萄糖与银氨溶液共热都有光亮的银镜生成 |
B、有机物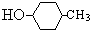 的消去产物有两种 的消去产物有两种 |
| C、鸡蛋清溶液中加入饱和(NH4)2SO4溶液后产生沉淀,是因为蛋白质发生了盐析 |
| D、沾附在试管内壁上的油脂,用热碱液洗涤 |
查看答案和解析>>
科目:高中化学 来源: 题型:
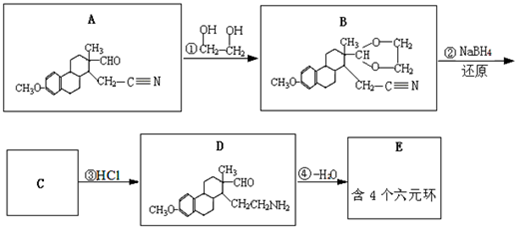
 (提示:①合成过程中无机试剂任选,②合成反应流程图表示方法示例如下:A→B→C…→H.)
(提示:①合成过程中无机试剂任选,②合成反应流程图表示方法示例如下:A→B→C…→H.)查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
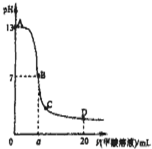 向15mL 0.1mol?L-1KOH溶液中逐滴加入0.2mol?L-1甲酸(HCOOH,一元弱酸)溶液,溶液pH和加入的甲酸的体积关系曲线如右图所示,有关粒子浓度大小关系正确的是( )
向15mL 0.1mol?L-1KOH溶液中逐滴加入0.2mol?L-1甲酸(HCOOH,一元弱酸)溶液,溶液pH和加入的甲酸的体积关系曲线如右图所示,有关粒子浓度大小关系正确的是( )| A、在A、B间任意一点c(K+)>c(HCOO-)>c(OH-)>c(H+) |
| B、在B点:c(K+)=c(HCOO-)>c(OH-)=c(H+),且a=7.5 |
| C、在C点:c(HCOO-)>c(K+)>c(OH-)>c(H+) |
| D、在D点:c(HCOO-)+c(HCOOH)>2c(K+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
 在海底和青藏高原都发现了名为“可燃冰”的环保型新能源,主要成分是CH4,CH4在光照下可与Cl2反应,也可以用CH4和H2O为原料制备二甲醚和甲醇等新型燃料.
在海底和青藏高原都发现了名为“可燃冰”的环保型新能源,主要成分是CH4,CH4在光照下可与Cl2反应,也可以用CH4和H2O为原料制备二甲醚和甲醇等新型燃料.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①② | B、②④ | C、③④ | D、②⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、AlCl3溶液中加入过量氨水 |
| B、Al2(SO4)3溶液中加入过量KOH溶液 |
| C、MgCl2溶液中加入过量氢氧化钠 |
| D、澄清石灰水中通入过量CO2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com