
下列物质按照纯净物、混合物、电解质和非电解质顺序排列的是( )
A.胆矾、漂白粉、氯化钾、氯气 B.冰醋酸、福尔马林、硫酸钠、乙醇
C.单甘油酯、混甘油酯、苛性钾、石灰石 D.盐酸、水煤气、醋酸、干冰
科目:高中化学 来源: 题型:
某一反应体系有反应物和生成物共五种物质:
O2、H2CrO4、Cr(OH)3、H2O、H2O2
已知该反应中H2O2只发生如下过程:H2O2→ O2
(1)该反应中的还原剂是 。
(2)该反应中,发生还原反应的过程是 → 。
(3)如反应转移了0.3mol电子,则产生的气体在标准状况下体积为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
二氧化碳是引起“温室效应”的主要物质,节能减排,高效利用能源,能够减少二氧化碳的排放。
(1)在一定温度下的2L固定容积的密闭容器中,通入2 molCO2和3mol H2,发生的反应为:CO2(g)+3H2(g) ⇌ CH3OH(g)+H2O(g),△H=-a kJ·mol-1(a>0), 测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。
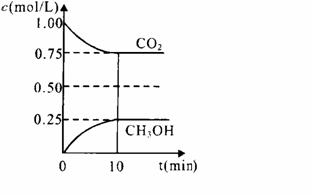
①能说明该反应已达平衡状态的是________。(选填编号)
A.CO2的体积分数在混合气体中保持不变
B.混合气体的平均相对分子质量不随时间的变化而变化
C.单位时间内每消耗1.2mol H2,同时生成0.4molH2O
D.该体系中H2O与CH3OH的物质的量浓度之比为1:1,且保持不变
②计算该温度下此反应的平衡常数K=_________。(保留两位有效数字)。若改变条件 (填选项),可使K=1。
A.增大压强 B.增大反应物浓度 C.降低温度
D.升高温度 E.加入催化剂
(2)某甲醇燃料电池原理如图1所示。
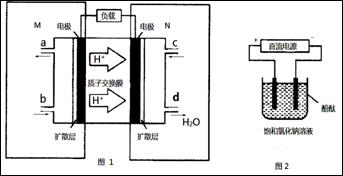
①M区发生反应的电极反应式为_______________________________。
②用上述电池做电源,用图2装置电解饱和食盐水(电极均为惰性电极),则该电解的总反应离子方程式为: 。假设溶液体积为300mL,当溶液的pH值变为13时(在常温下测定),理论上消耗甲醇的质量为______________(忽略溶液体积变化)。
(3)有一种用CO2生产甲醇燃料的方法:
已知:CO2(g)+3H2(g) ⇌ CH3OH(g)+H2O(g) △H=-a kJ·mol-1;
CH3OH(g)=CH3OH(l) △H=-b kJ·mol-1;
2H2(g)+O2(g)=2H2O(g) △H=-c kJ·mol-1;
H2O(g)=H2O(l) △H=-d kJ·mol-1,
则表示CH3OH(l)燃烧热的热化学方程式为:_____________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
热化学方程式C(s)+H2O(g)= CO(g)+H2(g) △H =+131.3kJ/mol表示( )
A.碳和水反应吸收131.3kJ能量
B.1mol碳和1mol水反应生成一氧化碳和氢气并吸收131.3kJ热量
C.1mol固态碳和1mol水蒸气反应生成一氧化碳气体和氢气,并吸热131.3kJ
D.1个固态碳原子和1分子水蒸气反应吸热131.1kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
有下列3种有机化合物 A:CH2=CH2 B: C:CH3COOH
C:CH3COOH
(1)写出化合物A、C中官能团的名称 、______________;
(2)3种化合物中能使溴的四氯化碳溶液褪色的是 (写名称);反应的化学方程为: ;具有特殊气味、常做有机溶剂的是 (写名称)。
(3)3种化合物中能与NaOH发生中和反应的是 (写名称) 。
查看答案和解析>>
科目:高中化学 来源: 题型:
将4.48g Fe溶于1L 0.2mol·L-1的稀硫酸,再加入50mL 0.4mo1·L-1KNO3溶液后,其中的Fe2+全部转化成Fe3+,NO3-无剩余,生成一种氮氧化物NYOX。则该氮氧化物的化学式是( )
A.N2O B.NO C.N2O3 D.NO2
查看答案和解析>>
科目:高中化学 来源: 题型:
Li-SOCl2电池可用于心脏起搏器。电极材料分别为锂和碳,电解液是LiAlCl4—SOCl2。电池的总反应可表示为:4Li+2SOCl2=4LiCl +S +SO2。电池工作时,下列说法不正确的是 ( )
A.锂电极发生氧化反应 B.电子从锂电极通过外电路流向碳电极
C.每生成1mol SO2转移4mol电子 D.SOCl2既是氧化剂又是还原剂
查看答案和解析>>
科目:高中化学 来源: 题型:
锌锰干电池在放电时,电池总反应方程式可表示为:Zn+2MnO2+2NH4+=Zn 2++ Mn2O3+2NH3+H2O
在电池放电时,正极(碳棒)上发生反应的物质是
A. Zn B. 碳棒 C. MnO2和NH4+ D. Zn 2+和NH4+
查看答案和解析>>
科目:高中化学 来源: 题型:
研究氮氧化物与悬浮在大气中海盐粒子的相互作用时,涉及如下反应:
2NO2(g)+NaCl(s)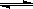 NaNO3(s)+ClNO(g) K1 Q > 0(I)
NaNO3(s)+ClNO(g) K1 Q > 0(I)
2NO(g)+Cl2(g)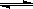 2ClNO(g) K2 Q > 0 (II)
2ClNO(g) K2 Q > 0 (II)
28.由(I)(II)得到:4NO2(g)+2NaCl(s)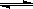 2NaNO3(s)+2NO(g)+Cl2(g)式子,请写出平衡常数表达式K= 。
2NaNO3(s)+2NO(g)+Cl2(g)式子,请写出平衡常数表达式K= 。
29.(2)为研究不同条件对反应(II)的影响,在恒温条件下,向 2L恒容密闭容器中加入0.2mol NO和0.1mol Cl2,10min时反应(II)达到平衡。测得10min内V(ClNO)=7.5×10-3mol?L-1?min-1,则平衡后n(Cl2)= mol,NO的转化率а1= 。30.其它条件保持不变,反应(II)在恒压条件下进行,平衡时NO的转化率а2 а1(填“>”“<”或“=”),平衡常数K2 (填“增大”“减小”或“不变”)。31.若要使K2减小,可采用的措施是 。
32.实验室可用NaOH溶液吸收NO2,反应为2NO2+2NaOH→NaNO3+NaNO2+H2O。含0.2mol NaOH的水溶液与0.2mol NO2恰好完全反应得 1L溶液A,溶液B为0.1mol?L?1的CH3COONa溶液,则两溶液中c(NO3?)、c(NO2?)和c(CH3COO?)由大到小的顺序为 。(已知HNO2的电离常数Ki=7.1×10-4mol?L?1,CH3COOH的电离常数K i=1.7×10-5mol?L?1)。
33.可使溶液A和溶液B的pH相等的方法是 。
a.向溶液A中加适量水 b.向溶液A中加适量NaOH
c.向溶液B中加适量水 d..向溶液B中加适量NaOH
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com