
有一个未完成的离子方程式 +XO3-+6H+=3X2+3H2O。据此判断下列说法中正确的是
A.X可能是周期表中第二周期元素
B.X元素的原子最外层上有7个电子
C.X2是还原产物,H2O是氧化产物
D.若生成3 mol X2,转移6 mol电子
科目:高中化学 来源:2014高考名师推荐化学--预测14 题型:推断题
碱式碳酸铜和氯气都是用途广泛的化工原料。
(1)工业上可用酸性刻蚀废液(主要成分有Cu2+、Fe2+、Fe3+、H +、Cl?)制备碱式碳酸铜,其制备过程如下:
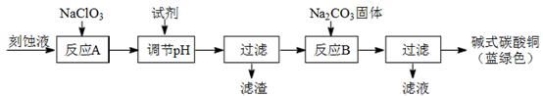
已知:Cu2+、Fe2+、Fe3+生成沉淀的pH如下:
物质 | Cu(OH)2 | Fe (OH)2 | Fe (OH)3 |
开始沉淀pH | 4.2 | 5.8 | 1.2 |
完全沉淀pH | 6.7 | 8.3 | 3.2 |
①氯酸钠的作用是 ;
②反应A后调节溶液的pH范围应为 。
③第一次过滤得到的产品洗涤时,如何判断已经洗净? 。
④造成蓝绿色产品中混有CuO杂质的原因是 。
(2)某学习小组在实验室中利用下图所示装置制取氯气并探究其性质。
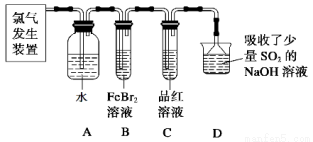
①实验室用二氧化锰和浓盐酸加热制取氯气,所用仪器需要检漏有 。
②若C中品红溶液褪色,能否证明氯气与水反应的产物有漂白性,说明原因 。此时B装置中发生反应的离子方程式是 。
③写出A溶液中具有强氧化性微粒的化学式 。若向A溶液中加入NaHCO3粉末,会观察到的现象是 。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测12 题型:填空题
锂的化合物用途广泛。Li3N是非常有前途的储氢材料;LiFePO4、Li2FeSiO4等可以作为电池的正级材料。回答下列问题:
(1)将锂在纯氮气中燃烧可制得Li3N,其反应的化学方程为 。
(2)氮化锂在氢气中加热时可得到氨基锂(LiNH2),其反应的化学方程式为:
Li3N+2H2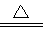 LiNH2+2LiH,氧化产物为 (填化学式)。在270℃时,该反应可逆向发生放出H2,因而氮化锂可作为储氢材料,储存氢气最多可达Li3N质量的 %(精确到0.1)。
LiNH2+2LiH,氧化产物为 (填化学式)。在270℃时,该反应可逆向发生放出H2,因而氮化锂可作为储氢材料,储存氢气最多可达Li3N质量的 %(精确到0.1)。
(3)将Li2CO3、FeC2O4·2H2O和SiO2粉末均匀混合,在800℃的氩气中烧结6小时制得Li2FeSiO4,写出反应的化学方程式 ,制备Li2FeSiO4的过程必须在惰性气体氛围中进行,其原因是 。
(4)将一定浓度磷酸二氢铵、氯化锂混合溶液作为电解液,以铁棒为阳极,石墨为阴极,电解析出LiFePO4沉淀,阳极的电极反应式为 。
(5)磷酸亚铁锂电池充放电过程中,发生LiFePO4与Li FePO4之间的转化,电池放电时负极发生的反应为LiXC6-Xe—
FePO4之间的转化,电池放电时负极发生的反应为LiXC6-Xe— XLi++6C,写出电池放电时的电极反应的化学方程式 。
XLi++6C,写出电池放电时的电极反应的化学方程式 。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测12 题型:选择题
有关下列装置的叙述不正确的是
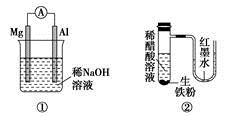
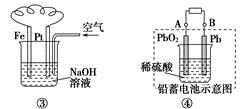
A.图①铝片发生的电极反应式是:Al+4OH--3e-===AlO2-+2H2O
B.图②发生析氢腐蚀,离子反应方程式为:Fe+2H+===Fe2++H2↑
C.图③溶液中发生了变化:4Fe(OH)2+O2+2H2O===4Fe(OH)3
D.图④充电时,阳极反应是:PbSO4+2H2O-2e-===PbO2+SO42-+4H+
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测11 题型:简答题
【物质结构与性质】
根据元素周期表中第四周期元素的相关知识,回答下列问题:
(1)第四周期元素的基态原子的电子排布中4s轨道上只有1个电子的元素有________种;写出Cu+的核外电子排布式________。
(2)按电子排布,可将周期表里的元素划分成五个区域,第四周期元素中属于s区的元素有________种,属于d区的元素有________种。
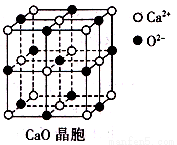
(3)CaO晶胞如所示,CaO晶体中Ca2+的配位数为 ;CaO的焰色反应为砖红色,许多金属或它们的化
合物都可以发生焰色反应,其原因是_______。
(4)由叠氮化钾(KN3)热分解可得纯N2:2KN3(s)=2K(l)+3N2(g),下列有关说法正确的是_______(填选项字母)。
A NaN3与KN3结构类似,前者晶格能较小
B晶体钾的晶胞结构如图所示: ,每个晶胞中分摊2个钾原子
,每个晶胞中分摊2个钾原子
C氮的第一电离能大于氧
D氮气常温下很稳定,是因为氮的电负性小
(5)二氧化钛(TiO2)是常用的、具有较高催化活性和稳定性的光催化剂。O2在其催化作用下,可将CN-氧化成CNO-。CN-的电子式为_______,CNO-的中心原子的杂化方式为______。
(6)在CrCl3溶液中,一定条件下存在组成为[CrCln(H2O)6-n]x+ (n和x均为正整数)的配离子,将其通过氢离子交换树脂(R-H),可发生离子交换反应:
[CrCln(H2O)6-n]X++ xR- Rx[CrCln(H2O)6-n]+xH+。将含0.0015 mol[CrCln(H2O)6-n]x+的溶液,与R-H完全交换后,中和生成的H+需浓度为0.1200 mol·L-1NaOH溶液25.00 mL,则该配离子的化学式为_______。
Rx[CrCln(H2O)6-n]+xH+。将含0.0015 mol[CrCln(H2O)6-n]x+的溶液,与R-H完全交换后,中和生成的H+需浓度为0.1200 mol·L-1NaOH溶液25.00 mL,则该配离子的化学式为_______。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测11 题型:选择题
容器中发生一个化学反应,反应过程中存在H2O、H2S、S、NH4+、H+、NO3—六种物质。在反应过程中测得NO3—和S的物质的量随时间变化的曲线如图所示。下列有关判断中正确的是
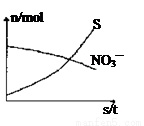
A.配平后氧化剂与还原剂的化学计量数之比为1:4
B.硫元素在反应中被还原
C.还原剂是含NH4+的物质
D.若生成1molNH4+,则转移电子2mol。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测10 题型:填空题
一定条件下发生反应:CO(g)+2H2(g) CH3OH(g)。工业上依此用CO生产燃料甲醇。
CH3OH(g)。工业上依此用CO生产燃料甲醇。
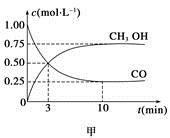
(1)甲图是反应时CO和CH3OH(g)的浓度随时间变化情况。从反应开始到平衡,用H2浓度变化表示平均反应速率v(CO)=__________________。
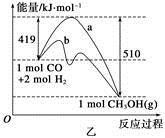
(2)乙图表示该反应进行过程中能量的变化。曲线b下的反应条件为 。该反应的焓变是________(填“ΔH<0”或“ΔH>0”),写出反应的热化学方程式 ;选择适宜的催化剂______(填“能”或“不能”)改变该反应的反应热。
(3)该反应平衡常数K的表达式为______________________,温度升高,平衡常数K________(填“增大”、“不变”或“减小”)。
(4)恒容条件下,下列措施中能使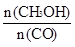 增大的有____________。
增大的有____________。
a.降低温度 b.充入He气
c.再充入1molCO和2molH2 d.使用催化剂
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测10 题型:选择题
某同学通过系列实验探究硫及其化合物的性质,实验现象正确且能达到目的的是
A.点燃硫磺.产生刺激性气味气体,该气体可以漂白纸浆
B.向蔗糖中加入浓硫酸,蔗糖变黑色,说明浓硫酸具有强的吸水性
C.将H2S气体通入CuSO4溶液生成CuS沉淀,说明H2S为强电解质
D.将Al片加入浓硫酸中,反应剧烈,说明浓硫酸具有强的氧化性
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--线索综合2 题型:简答题
CuCl2溶液中的铜主要以Cu(H2O)42+、CuCl42-形式存在,它们间有如下转化关系:Cu(H2O)42+(蓝色)+4Cl- CuCl42-(黄色)+4H2O;电解不同浓度的CuCl2溶液,均可看做Cu2+、Cl-直接放电。下图为电解浓度较大CuCl2溶液的装置,实验开始后,观察到丙中的KI-淀粉溶液慢慢变蓝。回答下列问题:
CuCl42-(黄色)+4H2O;电解不同浓度的CuCl2溶液,均可看做Cu2+、Cl-直接放电。下图为电解浓度较大CuCl2溶液的装置,实验开始后,观察到丙中的KI-淀粉溶液慢慢变蓝。回答下列问题:
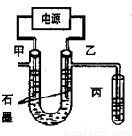
(1)甲电极的电极反应式为_________________。
(2)丙中溶液变蓝是乙电极产物与KI反应导致的,该反应的化学方程式为___。
(3)随电解的不断进行,U型管中溶液的颜色变化为__________;
A.由黄色变为浅蓝色 B.由蓝色变为浅黄色
溶液颜色变化的原因是_________________。
(4)当电解到一定程度,甲电极附近出现蓝色Cu(OH)2絮状物。经测甲电极附近溶液的pH=a,此时甲电极附近溶液中c(Cu2+)=______ mol·L-1。(已知:Cu(OH)2的Ksp=2.2×10-20)
(5)电解较长时间后,丙中溶液的蓝色又会褪去,这是因为乙电极产物进一步将I2氧化为IO3-,该反应的离子方程式为_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com