
ÖŲøõĖįŃĪ¹ć·ŗÓĆ×÷Ńõ»Æ¼Į”¢Ę¤øļÖĘ×÷µČ”£ŅŌøõæóŹÆ£ØÖ÷ŅŖ³É·ÖŹĒCr2O3£¬ŗ¬FeO”¢Al2O3”¢ SiO2µČŌÓÖŹ)ĪŖŌĮĻÖĘČ”ÖŲøõĖįÄʵÄĮ÷³ĢČēĻĀ£ŗ
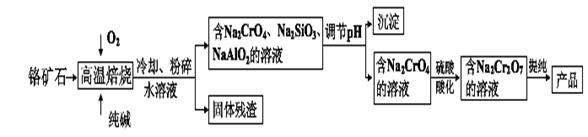 Ēė»Ų“šĻĀĮŠĪŹĢā£ŗ
Ēė»Ų“šĻĀĮŠĪŹĢā£ŗ
£Ø1£©Š“³öCr2O3Óė“æ¼īŌŚøßĪĀ±ŗÉÕŹ±·“Ó¦µÄ»Æѧ·½³ĢŹ½ £»
£Ø2£©Na2Cr2O7æÉÓĆÓŚ²ā¶Ø·ĻĖ®µÄ»ÆѧŗÄŃõĮæ£Ø¼“COD£¬ÖøĆæÉżĖ®ŃłÖŠ»¹ŌŠŌĪļÖŹ±»Ńõ»ÆĖłŠčŅŖO2µÄÖŹĮ棩”£ĻÖӊijĖ®Ńł100.00 mL£¬Ėį»Æŗó¼ÓČėC1 mol/LµÄNa2Cr2O7ČÜŅŗ V1 mL£¬Ź¹Ė®ÖŠµÄ»¹ŌŠŌĪļÖŹĶźČ«±»Ńõ»Æ£ØCr2O72-»¹ŌĪŖCr3+£©£»ŌŁÓĆC2mol/LµÄFeSO4ČÜŅŗµĪ¶ØŹ£ÓąµÄCr2O72-£¬½į¹ūĻūŗÄFeSO4ČÜŅŗV2 mL”£
¢ŁøĆĖ®ŃłµÄCODĪŖ mg/L£»
¢Ś¼ŁÉčÉĻŹö·“Ó¦ŗóĖłµĆČÜŅŗÖŠFe3+ŗĶCr3+µÄĪļÖŹµÄĮæÅØ¶Č¾łĪŖ0.1 mol/L£¬ŅŖŹ¹Fe3 +³ĮµķĶźČ«¶ųCr3+»¹Ī“æŖŹ¼³Įµķ£®ŌņŠčµ÷½ŚČÜŅŗpHµÄ·¶Ī§ŹĒ_ .
(æÉÄÜÓƵ½µÄŹż¾Ż£ŗKSPFe(OH)3=4.0”Į10-38, KSPCr(OH)3=6.0”Į10-31£¬
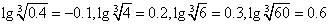
£Ø3£©ŌŚNa2Cr207ČÜŅŗÖŠ¼ÓČė¹ĢĢåKC1½ųŠŠø“·Ö½ā·“Ó¦¼“æÉÖĘµĆ³ČÉ«µÄK2Cr207”£
ÖŲøõĖįŃĪŌŚĖįŠŌČÜŅŗÖŠŹĒĒæŃõ»Æ¼Į£¬ŌŚ¼ÓČČŹ±æÉŃõ»ÆHBrŗĶHC1£¬ŌŚÕāŠ©·“Ó¦ÖŠ£¬ÖŲøõĖįŃĪµÄ»¹Ō²śĪļŹĒĀĢÉ«Cr3+µÄŃĪ£¬Š“³öÖŲøõĖį¼ŲÓėÅØŃĪĖį·“Ó¦µÄĄė×Ó·½³ĢŹ½£ŗ
ӣ
ĪŖŃéÖ¤Ā±ĖŲµ„ÖŹŃõ»ÆŠŌµÄĻą¶ŌĒæČõ£¬Ä³»ÆѧŠĖȤŠ”×éÓĆĻĀĶ¼ĖłŹ¾×°ÖĆ½ųŠŠŹŌŃé(¼Š³ÖŅĒĘ÷ŅŃĀŌČ„,ĘųĆÜŠŌŅŃ¼ģŃé)

ŹµŃé¹ż³Ģ:
¢ń.“ņæŖµÆ»É¼Š,“ņæŖ»īČūa,µĪ¼ÓÅØŃĪĖį”£
¢ņ.µ±BŗĶCÖŠµÄČÜŅŗ¶¼±äĪŖ³ČÉ«Ź±,¼Š½ōµÆ»É¼Š”£
¢ó.µ±BÖŠČÜŅŗ³ČÉ«±äÉīŹ±,¹Ų±Õ»īČūa”£
¢ō.”””
¢Ł ŃéÖ¤ĀČĘųµÄŃõ»ÆŠŌĒæÓŚµāµÄŹµŃéĻÖĻóŹĒ ”””£
¢ŚĪŖŃéÖ¤äåµÄŃõ»ÆŠŌĒæÓŚµā,¹ż³Ģ¢ōµÄ²Ł×÷ŗĶĻÖĻóŹĒ ”””£
¢Ū¹ż³Ģ¢óŹµŃéµÄÄæµÄŹĒ ”””£
£Ø1£©2Cr2O3 + 4Na2CO3 + 3O2 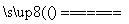 4Na2CrO4+4CO2
4Na2CrO4+4CO2
£Ø2£©¢Ł 480C1V1-80C2V2 ¢Ś 3.2”«4.3Ö®¼ä
£Ø3£©Cr2072- + 6Cl- + 14H+ = 2Cr3+ + 3CI2 ”ü + 7H20
¢Łµķ·ŪKIŹŌÖ½±äĄ¶ £Ø1·Ö£©
¢Ś“ņæŖ»īČūb£¬½«ÉŁĮæCÖŠČÜŅŗµĪČėDÖŠ£¬¹Ų±Õ»īČūb£¬Č”ĻĀDÕšµ“”£¾²ÖĮŗóCCl4²ćČÜŅŗ±äĪŖ×ĻŗģÉ«
¢ŪČ·ČĻCµÄ»ĘÉ«ČÜŅŗÖŠĪŽCl2£¬ÅųżCL2¶ŌäåÖĆ»»µāŹµŃéµÄøÉČÅ”£


 ĢģĢģĻņÉĻŅ»±¾ŗĆ¾ķĻµĮŠ“š°ø
ĢģĢģĻņÉĻŅ»±¾ŗĆ¾ķĻµĮŠ“š°ø Š”ѧɜ10·ÖÖÓÓ¦ÓĆĢāĻµĮŠ“š°ø
Š”ѧɜ10·ÖÖÓÓ¦ÓĆĢāĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
ŌŚŹ¢ÓŠäåĖ®µÄČżÖ§ŹŌ¹ÜÖŠ·Ö±š¼ÓČė±½”¢ĖÄĀČ»ÆĢ¼ŗĶ¾Ę¾«£¬Õńµ“ŗó¾²ÖĆ£¬³öĻÖČēĶ¼ĖłŹ¾ĻÖĻó£¬Ōņ¼ÓČėµÄŹŌ¼Į·Ö±šŹĒ
 A£®¢ŁŹĒ±½£¬¢ŚŹĒCCl4£¬¢ŪŹĒ¾Ę¾«
A£®¢ŁŹĒ±½£¬¢ŚŹĒCCl4£¬¢ŪŹĒ¾Ę¾«
B£®¢ŁŹĒ¾Ę¾«£¬¢ŚŹĒCCl4£¬¢ŪŹĒ±½
C£®¢ŁŹĒCCl4£¬¢ŚŹĒ±½ £¬¢ŪŹĒ¾Ę¾«
£¬¢ŪŹĒ¾Ę¾«
D£®¢ŁŹĒ±½£¬¢ŚŹĒ¾Ę¾«£¬¢ŪŹĒCCl4
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
¹ŲÓŚ»Æѧ·“Ó¦ÓėÄÜĮæµÄĖµ·ØÕżČ·µÄŹĒ
A£®ÖŠŗĶ·“Ó¦ŹĒĪüČČ·“Ó¦ B£®Č¼ÉÕŹōÓŚ·ÅČČ·“Ó¦
C£®»Æѧ¼üŠĪ³ÉĪüŹÕÄÜĮæ D£®·“Ó¦Īļ×ÜÄÜĮæÓėÉś³ÉĪļ×ÜÄÜĮæŅ»¶ØĻąµČ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
1.52g ĶĆ¾ŗĻ½šĶźČ«ČܽāÓŚ50mL ĆܶČĪŖ1.40 g/mL”¢ÖŹĮæ·ÖŹżĪŖ63%µÄÅØĻõĖįÖŠ£¬µĆµ½NO2ŗĶN2O4µÄ»ģŗĻĘųĢå1120 mL£Ø±ź×¼×“æö£©£¬Ļņ·“Ó¦ŗóµÄČÜŅŗÖŠ¼ÓČė1.0 mol/L NaOHČÜŅŗ£¬µ±½šŹōĄė×ÓČ«²æ³ĮµķŹ±£¬µĆµ½2.54 g³Įµķ”£ĻĀĮŠĖµ·Ø²»ÕżČ·µÄŹĒ
A£®øĆŗĻ½šÖŠĶÓėĆ¾µÄĪļÖŹµÄĮæÖ®±ČŹĒ2:1
B. øĆÅØĻõĖįÖŠHNO3µÄĪļÖŹµÄĮæÅØ¶ČŹĒ14.0 mol/L
C£®NO2ŗĶN2O4µÄ»ģŗĻĘųĢåÖŠ£¬NO2µÄĢå»ż·ÖŹżŹĒ80%
D£®µĆµ½2.54 g³ĮµķŹ±£¬¼ÓČėNaOHČÜŅŗµÄĢå»żŹĒ600 mL
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
ŹŅĪĀŹ±£¬ĻĀĮŠĖµ·ØÖŠ£¬ÕżČ·µÄŹĒ
A£®0.l mol/L“×ĖįøĘČÜŅŗÖŠ£¬c£ØCa2+£©£¾c£ØCH3COO-£©£¾c£ØOH-£©£¾c£ØH+£©
B£®Ģå»żŗĶpH¶¼ĻąĶ¬µÄNH4ClČÜŅŗ”¢ŃĪĖį£¬ĶźČ«ČܽāÉŁĮæĒŅµČÖŹĮæµÄŠæ·Ū£¬Ē°ÕßĖłÓĆŹ±¼äÉŁ
C£®½«n mol H2(g)”¢n mol I2(g)ŗĶ2n mol H2 (g)”¢2n mol I2(g)·Ö±š³äČėĮ½øöŗćĪĀŗćČŻµÄČŻĘ÷ÖŠ£¬Ę½ŗāŹ±H2µÄ×Ŗ»ÆĀŹĒ°Õߊ”ÓŚŗóÕß
D£®Ä³ĪļÖŹµÄČÜŅŗÖŠÓÉĖ®µēĄė³öµÄc(H+)=1”Į10£a mol”¤L£1£¬Čōa£¾7Ź±£¬ŌņøĆČÜŅŗµÄpHŅ»¶ØĪŖ14-a
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
æĘѧ¼ŅĢį³ö¹čŹĒ”°21ŹĄ¼ĶµÄÄÜŌ“”±£¬ÕāÖ÷ŅŖŹĒÓÉÓŚ×÷ĪŖ°ėµ¼Ģå²ÄĮĻµÄ¹čŌŚĢ«ŃōÄÜ·¢µē¹ż³ĢÖŠ¾ßÓŠÖŲŅŖµÄ×÷ÓĆ”£ĻĀĮŠ¹ŲÓŚ¹čµÄĖµ·ØÖŠÕżČ·µÄŹĒ ( )
A. ×ŌČ»½ē¹čµÄÖüĮæ·įø»
B£®×ŌČ»½ēÖŠ“ęŌŚ“óĮæµ„ÖŹ¹č
C£®øß“æ¶ČµÄ¶žŃõ»Æ¹č±»ÓĆÓŚÖĘ×÷¼ĘĖ滜Š¾Ę¬
D£®¹āµ¼ĻĖĪ¬µÄÖ÷ŅŖ³É·ÖŹĒSi
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
ĻĀĮŠŹµŃéĻÖĻó£¬ÓėŠĀÖĘĀČĖ®ÖŠµÄijŠ©³É·Ö£ØĄØŗÅÄŚĪļÖŹ£©Ć»ÓŠ¹ŲĻµµÄŹĒ £Ø £©
A. ĻņNaHCO3¹ĢĢåÖŠ¼ÓČėŠĀÖʵÄĀČĖ®£¬ÓŠĪŽÉ«ĘųÅŻ²śÉś£ØH+£©
B. ŠĀÖĘĀČĖ®Ź¹ŗģÉ«²¼ĢõĶŹÉ«£ØHCl£©
C. ½«AgNO3ČÜŅŗµĪ¼Óµ½ŠĀÖĘĀČĖ®ÖŠ£¬ÓŠ°×É«³Įµķ²śÉś£ØCl-£©
D. ĻņFeCl2ČÜŅŗÖŠµĪ¼ÓŠĀÖĘĀČĖ®£¬ŌŁµĪ¼ÓKSCNČÜŅŗ£¬ČÜŅŗ³ŹŗģÉ«£ØCl2£©
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
Ō×Ó½į¹¹Ä£ŠĶµÄŃŻ±äĶ¼ČēÓŅ£ŗ
 |
ĘäÖŠ£¬¢ÅĪŖµĄ¶ū¶ŁŹµŠÄĒņŹ½Ō×ÓÄ£ŠĶ”¢¢ĘĪŖĀ¬ÉŖø£ŠŠŠĒŌĖ×ŖŹ½Ō×ÓÄ£ŠĶ”¢¢ĒĪŖĢĄÄ·ÉśĘĻĢŃøÉĆę°üŹ½Ō×ÓÄ£ŠĶ”¢¢ČĪŖ½ü“śĮæ×ÓĮ¦Ń§Ō×ÓÄ£ŠĶ”¢¢ÉĪŖ²£¶ū¹ģµĄŹ½Ō×ÓÄ£ŠĶ”£ĻĀĮŠ·ūŗĻĄśŹ·ŃŻ±äĖ³ŠņµÄŅ»×éÅÅĮŠŹĒ£Ø £©
A£®¢Å¢Ę¢Ē¢Č¢É B£®¢Å¢Ē¢Ę¢É¢Č C£®¢Å¢É¢Ē¢Ę¢Č D£®¢Å¢Ē¢É¢Č¢Ę
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
ŌŚÄ³ĢåĻµÄŚÓŠ·“Ó¦ĪļŗĶÉś³ÉĪļ5ÖÖĪļÖŹ£ŗH2S”¢S”¢FeCl3”¢FeCl2”¢HCl.ŅŃÖŖH2SĪŖ·“Ó¦Īļ£¬ŌņĮķŅ»·“Ó¦ĪļŹĒ(””””)
A£®FeCl3 B£®FeCl2 C£®S D£®HCl
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com