
【题目】某兴趣小组同学在实验室用加热l﹣丁醇、浓H2SO4和溴化钠混合物的方法来制备1﹣溴丁烷,设计了如下图所示的实验装置(其中的夹持仪器没有画出). 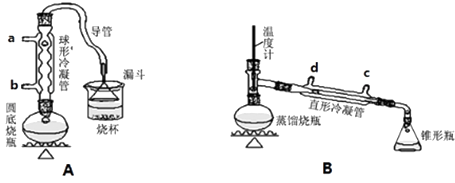
请回答下列问题:
(1)A装置中,在烧杯里的液面倒扣一个漏斗,其目的是 . 两个装置中都用到了冷凝管,A装置中冷水从(填字母代号)进入,B装置中冷水从(填字母代号)进入.
(2)制备操作中,加入的浓硫酸事先必须进行稀释,其目的是 . (填字母)
a.减少副产物烯和醚的生成 b.减少Br2的生成 c.水是反应的催化剂
(3)有同学拟通过红外光谱仪鉴定所得产物中是否含有“﹣CH2CH2CH2CH3”,来确定副产物中是否存在丁醚(CH3CH2CH2CH2OCH2CH2CH2CH3).请评价该同学设计的鉴定方案是否合理?为什么?答: .
(4)为了进一步提纯1﹣溴丁烷,该小组同学查得相关有机物的有关数据如下表:
物质 | 熔点/℃ | 沸点/℃ |
1﹣丁醇 | ﹣89.5 | 117.3 |
1﹣溴丁烷 | ﹣112.4 | 101.6 |
丁醚 | ﹣95.3 | 142.4 |
1﹣丁烯 | ﹣185.3 | ﹣6.5 |
则用B装置完成此提纯实验时,实验中要迅速升高温度至收集所得馏分.
【答案】
(1)既可以吸收充分,又可以防止倒吸;b;c
(2)ab
(3)不合理,产物1﹣溴丁烷也含有﹣CH2CH2CH2CH3
(4)101.6℃
【解析】解:(1.)倒置球形漏斗有缓冲作用,气体能充分被吸收且防止倒吸;冷凝管采用逆向通水,冷凝效果较好,所以A装置中冷水从b通入,B装置中冷水从c通入,故答案为:既可以吸收充分,又可以防止倒吸;b;c;
(2.)l﹣丁醇在浓硫酸的催化作用下发生分子内脱水制取丁烯,分子间脱水得到醚,发生分子间脱水形成醚CH3CH2CH2CH2OCH2CH2CH2CH3 , 分子内脱水生成正丁烯CH2=CHCH2CH3 , 同时有溴离子被浓硫酸氧化成溴单质,所以制备操作中,加入的浓硫酸事先必须进行稀释的目的是:减少副产物烯和醚的生成、减少Br2的生成,即ab正确,故答案为:ab;
(3.)红外光谱仪利用物质对不同波长的红外辐射的吸收特性,进行分子结构和化学组成分析,产物CH3CH2CH2CH2Br也含有﹣CH2CH2CH2CH3 , 所以不能通过红外光谱仪来确定副产物中是否存在丁醚(CH3CH2CH2CH2OCH2CH2CH2CH3),故答案为:不合理,产物1﹣溴丁烷也含有﹣CH2CH2CH2CH3;
(4.)提纯1﹣溴丁烷,收集所得馏分为1﹣溴丁烷,所以须将1﹣溴丁烷先汽化,后液化,汽化须温度达其沸点,1﹣溴丁烷的沸点为101.6℃,则实验中要迅速升高温度至101.6℃收集所得馏分故答案为:101.6℃.
(1)根据防倒吸的原理解答;冷凝管中采用逆向通水时,冷凝效果较好;(2)l﹣丁醇在浓硫酸的作用下,可发生分子间和分子内脱水;(3)根据红外光谱仪的作用,进行分子结构和化学组成分析;(4)根据1﹣溴丁烷的沸点为101.6℃解答.


 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案科目:高中化学 来源: 题型:
【题目】部分短周期元素原子半径的相对大小、最高正价或最低负价随原子序数的变化关系如图所示,下列说法正确的是

A. 离子半径的大小顺序:d<e<f
B. 与x形成简单化合物的沸点:y>z>d
C. 除去实验后试管中残留的g单质,可用热的氢氧化钠溶液
D. g、h的氧化物对应的水化物的酸性:h>g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NH4Cl溶液的pH和稀HCl的pH均为5,其中由水电离出的c(H+)分别为x molL﹣1和y molL﹣1 , 则x与y的比值正确的是( )
A.1
B.10
C.104
D.10﹣4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】糖类、油脂、蛋白质是人体重要的能源物质,请根据它们的性质回答以下问题:
(1)油脂在酸性和碱性条件下水解的共同产物是(写名称).
(2)蛋白质的水解产物具有的官能团是(写结构简式).
(3)已知A是人体能消化的一种天然高分子化合物,B和C分别是A在不同条件下的水解产物,它们有如下转化关系。
①下列说法不正确的是:
A、1molC完全水解可生成2molB
B、工业上常利用反应⑦给热水瓶胆镀银
C、用A进行酿酒的过程就是A的水解反应过程
D、A的水溶液可以发生丁达尔效应
E、反应③属于吸热反应
②请设计实验证明A通过反应①已经全部水解,写出操作方法、现象和结论
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中于一定条件下进行下列反应:2SO2+O22SO3当到达平衡时通入18O2 , 再次平衡时,18O存在于( )
A.SO2、O2
B.SO2、SO3
C.O2、SO3
D.SO2、O2、SO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO、SO2是主要的大气污染气体,利用化学反应原理是治理污染的重要方法。
I、甲醇可以补充和部分替代石油燃料,缓解能源紧张。利用CO可以合成甲醇。
(1) 已知:CO(g)+1/2O2(g)=CO2(g) △H1=-283.0kJ·mol-1
H2(g)+1/2O2(g)=H2O(l) △H2=-285.8kJ·mol-1
CH3OH(g)+3/2 O2(g)=CO2(g)+2H2O(l) △H3=-764.5kJ·mol-1
则CO(g)+2H2(g)=CH3OH(g) △H=____________kJ·mol-1
(2)一定条件下,在容积为2L的密闭容器中充入1mol CO与2 mol H2合成甲醇 平衡转化率与温度、压强的关系如右图所示。

①在2 min时测得容器内甲醇的浓度为0.25 mol·L-1,则0-2 min内CO的平均反应速率为____mol·L-1·min-1,H2的转化率为____。
②由图判断P1_______P2(填“>” 、“<” 或“=” ),理由是____________________________________
③该甲醇合成反应在A点的平衡常数K=____
④下列措施中能够同时满足增大反应速率和提高CO转化率的是____。(填写相 应字母)
A、使用高效催化剂 b、降低反应温度 c、增大体系压强
D、不断将CH3OH从反应混合物中分离出来
Ⅱ、某学习小组以SO2为原料,采用电化学方法制取硫酸。
(3)原电池法:
该小组设计的原电池原理如右图所示。

该电池中右侧为________极,写出该电池负极的电极反应式 ____。
(4)电解法:
该小组用Na2SO3溶液充分吸收SO2得到NaHSO3溶液,然后电解该溶液制得了硫酸。原理如右图所示。

写出开始电解时阳极的电极反应式____________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对下列物质进行的分类正确的是( )
A.纯碱、烧碱都属于碱B.CuSO4·5H2O属于电解质
C.凡能电离出H+的化合物都属于酸D.盐类物质一定含有金属阳离子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A.按系统命名法,化合物 ![]() (键线式结构)的名称是2,3,5,5﹣四甲基﹣4,4﹣二乙基己烷
(键线式结构)的名称是2,3,5,5﹣四甲基﹣4,4﹣二乙基己烷
B.环己烯与化合物  (键线式结构)互为同系物
(键线式结构)互为同系物
C.分子式为C4H8O2的有机物在酸性条件下可水解为酸和醇,若将所有可能得到的醇和酸重新酯化,可形成的酯共有16种
D.等物质的量的苯和苯甲酸完全燃烧消耗氧气的量相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,A处通入氯气,关闭弹簧夹B时,C处红色布条无明显的变化,打开弹簧夹B时,C处红色布条逐渐褪色。由此作出的判断正确的是( )

A. D中不可能是浓硫酸
B. D中可以是水
C. 通入的氯气中含有水蒸气
D. D中可以是饱和食盐水
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com