
【题目】下列解释事实的化学方程式或离子方程式正确的是
A. 用食醋除去暖水瓶中的水垢:2CH3COOH+CaCO3===Ca2++2CH3COO-+CO2↑+H2O
B. NaOH溶液中通入Cl2 :2Cl2 + 2OH- = 3Cl- + ClO- + H2O
C. 稀硫酸中加入铁粉 2Fe+6H+===2Fe3++3H2↑
D. Ca(HCO3)2溶液中加入少量的NaOH溶液:Ca2++2HCO+2OH-===CaCO3↓+CO![]() +2H2O
+2H2O
【答案】A
【解析】A.用食醋除去暖水瓶中的水垢,反应实质为醋酸与碳酸钙的反应,反应的离子方程式为:2CH3COOH+CaCO3=Ca2++2CH3COO-+CO2↑+H2O,故A正确;B.NaOH溶液中通入Cl2,反应生成氯化钠、次氯酸钠和水,离子方程式为:Cl2 + 2OH- = Cl- + ClO- + H2O,故B错误;C.稀硫酸中加入铁粉,反应生成亚铁离子和氢气,正确的离子方程式为:Fe+2H+=Fe2++H2↑,故C错误;D.氢氧化钠少量,反应生成碳酸钙沉淀,产物中不会有碳酸根离子,正确的离子方程式为:Ca2++HCO3-+OH- =CaCO3↓+H2O,故D错误;答案选A。


科目:高中化学 来源: 题型:
【题目】现有几种元素的性质或原子结构如下表:
元素编号 | 元素性质或原子结构 |
T | 失去一个电子后,形成Ne原子电子层结构 |
X | 最外层电子数是次外层电子数的2倍 |
Y | 其单质之一是空气中主要成分,最常见的助燃剂 |
Z | 形成双原子单质分子,黄绿色气体 |
(1)元素X的一种同位素用来作原子量标准,这种同位素的符号是__________。
(2)画出T的原子结构示意图__________。
(3)写出由T、Y和Z三种元素组成的一种化合物在水溶液中的电离方程式__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,已知:Ksp(AgCl)=1.8×10-10,Ksp(Ag2CrO4)=l.1×10-12以及Ksp[Cu(OH)2] =2×10-20。下列说法错误的是
A. 常温下AgCl饱和溶液和Ag2CrO4饱和溶液的物质的量浓度比较:c(AgCl)<c(Ag2CrO4)
B. 常温下,在0.010molL-1的AgNO3溶液中,AgCl与Ag2CrO4分别能达到的最大物质的量浓度比较:c(AgCl)<c(Ag2CrO4)
C. 某CuSO4溶液里c(Cu2+)=0.02 molL-1,如要生成Cu(OH)2沉淀,应调整溶液的pH,使之大于5
D. 要使0.2molL-1 CuSO4溶液中Cu2+沉淀较为完全(使Cu2+浓度降至原来的千分之一),则应向溶液里加入NaOH溶液,使溶液PH为6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现用金属钠和空气制备纯度较高的Na2O2,可利用的装置如下:
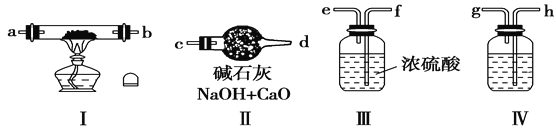
请回答下列问题:
(1)若规定气体的流动方向为从左到右,则组合实验装置时各仪器的连接顺序是:空气→Ⅳ→________→________→________(填“Ⅰ、Ⅱ、Ⅲ”,仪器不能重复使用)。
(2)装置Ⅳ中盛放的药品是___________,其作用是____________________。
(3)装置Ⅱ的作用是_________________________________________。
(4)加热装置Ⅰ时发生反应的化学方程式为___________________________。
(5)下列对于过氧化钠的叙述中,正确的是___________。
A.过氧化钠能与酸反应生成盐和水,所以过氧化钠是碱性氧化物
B.将过量Na2O2投入紫色石蕊试液中,溶液变蓝
C.过氧化钠与水反应时,过氧化钠是氧化剂,水是还原剂
D.过氧化钠与二氧化碳反应时,过氧化钠既是氧化剂又是还原剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知在常温常压下: ①2CH3OH(l)+2O2(g)═2CO(g)+4H2O(g)△H=﹣a kJmol﹣1
②2CO(g)+O2(g)═2CO2(g)△H=﹣b kJmol﹣1
③H2O(g)═H2O(l)△H=﹣c kJmol﹣1
则表示CH3OH(l)燃烧热的热化学方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃时,在浓度为1mol/L的(NH4)2SO4、(NH4)2CO3、(NH4)2Fe(SO4)2的溶液中,测其c(NH4+)分别为a、b、c(单位为mol/L),下列判断正确的是
A. a=b=c B. a>b>c C. a>c>b D. c>a>b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)质量之比为16∶7∶6的三种气体SO2、CO、NO,分子个数之比为________;氧原子个数之比为____________;相同条件下体积之比为________。
(2)某气体氧化物的化学式为RO2,在标准状况下,0.92 g 该氧化物的体积为448 mL,则该氧化物的摩尔质量为________,R的相对原子质量为________。RO2的化学式为______。
(3)常温下,在27.5 g水中溶解12.5 g CuSO4·5H2O,恰好达到饱和,该溶液的密度为1.60 g/cm3,则该溶液中CuSO4的物质的量浓度为____________,从中取出20.0 mL该溶液,配成浓度为1.00 mol/L的稀溶液,则稀释后溶液的体积是________mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,根据所给的10 种元素,回答下列间题.
族 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
2 | C | N | F | Na | ||||
3 | Na | Mg | Al | Si | S | Cl |
(1)非金属性最强的元素是;
(2)Ne 原子结构示意图为;
(3)C 与N 中,原子半径较小的是;
(4)氯水具有漂白作用,是由于其中含有(填“HCl”或“HClO”)
(5)元素最高价氧化物对应的水化物中,碱性最强的是(填化学式),呈两性的是(填化学式);
(6)元素硅的氧化物常用于制造(填一种高性能的现代通讯材料的名称);
(7)如图为某有机物的球棍模型(其中 ![]() 代表氢原子代表
代表氢原子代表 ![]() 碳原子),
碳原子), 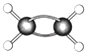 该有机物中碳元素与氢元素的质量比m(C):m(H)= . (相对原子质量C﹣12、H﹣1)
该有机物中碳元素与氢元素的质量比m(C):m(H)= . (相对原子质量C﹣12、H﹣1)
(8)镁是制造汽车、飞机、火箭的重要材料.写出工业上电解熔融氯化镁获得金属镁的化学方程式 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com