
 2SO2+O2 在550 ℃时的平衡常数是____________。
2SO2+O2 在550 ℃时的平衡常数是____________。  阶梯计算系列答案
阶梯计算系列答案科目:高中化学 来源: 题型:

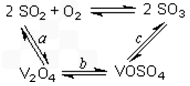
(1)催化氧化所使用的催化剂钒触媒(V2O5)能加快二氧化硫氧化速率,此过程中产生了一连串的中间体(如图)。其中a、c二步的化学方程式可表示为:___________________________、________________________。
(2)

(3)为循环利用催化剂,科研人员最新研制了一种离子交换法回收钒的新工艺,回收率达91.7%以上。已知废钒催化剂中含有V2O5、VOSO4及不溶性残渣。查阅资料知:VOSO4可溶于水,V2O5难溶于水,NH4VO3难溶于水。该工艺的流程如下图。

则:反应①②③④中属于氧化还原反应的是____________(填数字序号),反应①的离子方程式为____________________________________。该工艺中反应③的沉淀率(又称沉钒率)是回收钒的关键之一,沉钒率的高低除受溶液pH影响外,还需要控制氯化铵计量数(NH4Cl加入质量与料液中V2O5的质量比)和温度。根据下图试建议控制氯化铵计量数和温度:____________、____________。

查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
工业上以黄铁矿为原料生产硫酸主要分为三个阶段进行,即在沸腾炉中煅烧黄铁矿、SO2的催化氧化及其SO3的吸收。请回答下列几个有关硫酸工业中的几个问题。
(1)生产硫酸最古老的方法是以绿矾为原料,在蒸馏釜中煅烧。反应的化学方程式为:2FeSO4·7H2O ![]() Fe2O3 + SO2↑+ SO3↑+ 14H2O。其中三氧化硫与水蒸气同时冷凝便得到硫酸。用如图所示装置模拟用绿矾制硫酸的实验,并检验生成的硫酸和二氧化硫(加热装置已略去)。其中b为干燥的试管。下列关于该反应说法正确的是( )
Fe2O3 + SO2↑+ SO3↑+ 14H2O。其中三氧化硫与水蒸气同时冷凝便得到硫酸。用如图所示装置模拟用绿矾制硫酸的实验,并检验生成的硫酸和二氧化硫(加热装置已略去)。其中b为干燥的试管。下列关于该反应说法正确的是( )

A.若将反应后的三种气体通入BaCl2溶液中,产生的沉淀为BaSO3、BaSO4
B.b中产物用紫色石蕊试液即可检验出其中H+和SO42—
C.为检验反应的另一种生成物,试管c中应加入的试剂为NaOH溶液
D.b中所得到的硫酸的质量分数为29.5%
(2)从沸腾炉中出来的炉气必须经除尘、洗涤、干燥后进入接触室,其主要目的是__________。
(3)接触室中热交换器是实现冷热交换的装置。化学实验中也经常利用热交换来实现某种实验目的,如气、液热交换时通常使用的仪器是______________。
(4)接触室中主要反应是SO2的催化氧化,在生成硫酸的过程中,钒触媒(V2O5)所以能加快二氧化硫氧化的速度,除了具有吸附作用外,有人认为反应过程中还产生了一连串的中间体(如图)。c步的化学方程式可表示为_______________________。

(5) 工业上以硫铁矿为原料制硫酸所产生的尾气除了含有N2、O2外,还含有SO2、微量的SO3和酸雾。为了保护环境,同时提高硫酸工业的综合经济效益,应尽可能将尾气中的SO2转化为有用的副产品。将尾气通入粉末状的碳酸钙或熟石灰的悬浊液中,经过一系列处理后得到一种相对分子质量为172的化工原料J。试写出J的化学式_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)钒触媒(V2O5)能加快SO2的氧化速率,此过程中SO2先与V2O5反应生成V2O4。该过程的化学方程式可表示为__________________________________________。
(2)为测定过程中混合气的SO2体积分数,选用0.0500 mol/L I2的标准溶液、淀粉溶液进行测定。已知:V(耗用I2标准溶液)=10.00 mL,V(采集烟气)=100.0 mL(已折算为标准状况),则烟气中SO2 的体积分数为_____________________。
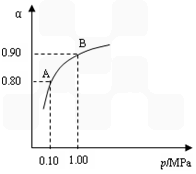
(3)一定温度时,SO2的平衡转化率(α)与体系总压强(p)的关系如图9所示。试分析工业生产中采用常压的原因是____________________。
图9
(4)在温度相同、体积均为1 L的三个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下。
已知:2SO2(g)+O2(g)![]() 2SO3(g) ΔH =-98.3 kJ·mol-1。
2SO3(g) ΔH =-98.3 kJ·mol-1。
| 容 器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 2 mol SO2、1 mol O2 | 2 mol SO3 | m mol SO2、n mol O2、 p mol SO3 |
| c(SO3) /mol·L-1 | 1.4 | 1.4 | 1.4 |
| 能量变化 | 放出a kJ | 吸收b kJ | 吸收c kJ |
| SO2或SO3的转化率 | α1 | α2 | 12.5% |
则:α1+α2=_________________,p=________________mol,b+c=_______________kJ 。
查看答案和解析>>
科目:高中化学 来源:2012届江苏省高三高考压轴化学试卷 (带解析) 题型:填空题
(1)钒触媒(V2O5)能加快SO2的氧化速率,此过程中SO2先与V2O5反应生成V2O4。该过程的化学方程式可表示为__________________________________________。
(2)为测定过程中混合气的SO2体积分数,选用0.0500 mol/L I2的标准溶液、淀粉溶液进行测定。已知:V(耗用I2标准溶液)="10.00" mL,V(采集烟气)="100.0" mL(已折算为标准状况),则烟气中SO2 的体积分数为_____________________。
(3)一定温度时,SO2的平衡转化率(α)与体系总压强(p)的关系如图9所示。试分析工业生产中采用常压的原因是____________________。
图9
(4)在温度相同、体积均为1 L的三个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下。
已知:2SO2(g)+O2(g) 2SO3(g) ΔH ="-98.3" kJ·mol-1。
2SO3(g) ΔH ="-98.3" kJ·mol-1。
| 容 器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 2 mol SO2、1 mol O2 | 2 mol SO3 | m mol SO2、n mol O2、 p mol SO3 |
| c(SO3) /mol·L-1 | 1.4 | 1.4 | 1.4 |
| 能量变化 | 放出a kJ | 吸收b kJ | 吸收c kJ |
| SO2或SO3的转化率 | α1 | α2 | 12.5% |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com