
已知A为淡黄色固体,T、R为两种常见的用途很广的金属单质,D是具有磁性的黑色晶体, C是无色无味的气体,H是白色沉淀,且在潮湿空气中迅速变为灰绿色,最终变为红褐色固体。
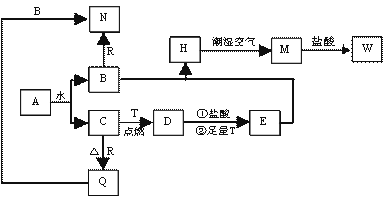
(1)写出下列物质的化学式:
A: D: R: 。
(2)按要求写下列反应方程式:
H在潮湿空气中变成M的过程中的化学方程式: ;
向N中通足量CO2时反应的离子方程式: ;
D与盐酸反应的离子方程式: 。
(3)简述检验气体C的方法: 。
【知识点】金属元素及其化合物的推断C1 C2 C3 C5
【答案解析】(1)A: Na2O2 D:Fe3O4 R:Al
(2) 4Fe(OH)2 +O2+2H2O=4Fe(OH)3
AlO2—+CO2+2H2O=Al(OH)3 ↓ +HCO3—
Fe3O4 + 8H+= Fe2+ + 2Fe3+ + 4H2O
(3)用带火星的木条伸入试管口,若带火星的木条复燃,说明有氧气生成。
解析:A为淡黄色固体,且A能和水反应,则A是Na2O2,A和水反应生成NaOH和O2,C是无色无味的气体,则C是O2、B是NaOH;D是具有磁性的黑色晶体是Fe3O4,Fe在氧气中燃烧生成四氧化三铁,则T是Fe,R和氧气反应生成氧化物Q,Q能和NaOH溶液反应,则Q是Al2O3、R是Al,N是NaAlO2,H是白色沉淀,且在潮湿空气中迅速变为灰绿色,最终变为红褐色固体M,则H是Fe(OH)2、M是Fe(OH)3,Fe3O4和HCl、Fe反应后得到E,E为FeCl2,Fe(OH)3和HCl反应生成W,则W是FeCl3,
(1)分析知,A、D、R分别是Na2O2、Fe3O4、Al;
(2)H是Fe(OH)2,Fe(OH)2不稳定,易被空气氧化生成Fe(OH)3,反应方程式为4 Fe(OH)2+O2+2H2O═4 Fe(OH)3,向NaAlO2中通足量CO2时反应的离子方程式AlO2—+CO2+2H2O=Al(OH)3 ↓ +HCO3—,四氧化三铁和稀盐酸反应生成氯化铁、氯化亚铁和水,离子反应方程式为:Fe3O4+8H+═Fe2++2Fe3++4H2O.
(3)C是氧气,用带火星的木条伸入试管口,若带火星的木条复燃,说明有氧气生成.
【思路点拨】本题Al、Fe及其化合物为载体考查了金属元素及其化合物的推断,H的颜色变化、A的颜色及性质、D的性质为突破口采用正逆结合的方法进行推断即可解答。


 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案科目:高中化学 来源: 题型:
磷酸燃料电池是目前较为成熟的燃料电池,其基本组成和反应原理如下。
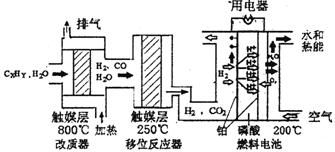
(1)在改质器中主要发生的反应为_______________________________
(2)移位反应器中CO(g)+H2O (g) 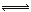 CO2 (g)+H2(g) ,在一定温度下,在1L容器中发生上述反应,各物质的物质的量浓度变化如下表:
CO2 (g)+H2(g) ,在一定温度下,在1L容器中发生上述反应,各物质的物质的量浓度变化如下表:
| t/min | COmol/L) | H2O(mol/L) | CO2(mol/L) | H2(mol/L) |
| 0 | 0.2 | 0.3 | 0 | 0 |
| 2 | n1 | n2 | n3 | 0.1 |
| 3 | n1 | n2 | n3 | 0.1 |
| 4 | 0.09 | 0.19 | 0.11 | 0.11 |
①此温度下,该反应的平衡常数为________
②反应在3~4 min之间,氢气的物质的量增多的原因可能是 (填代号)
A.充入水蒸汽 B.升高温度 C.使用催化剂 D.充入氢气
(3)磷酸燃料电池负极排出的气体主要是___ __,
该电池正极的电极反应为_ _ __。
(4)磷酸燃料电池的电极上镀了铂粉,这样做的目的,除了起到更好的导电作用外,还具备的作用是 。
(5)总体看来,整个体系中能量来自与CxHy与空气的反应,假设CxHy为辛烷,且
已知辛烷的燃烧热为5 518 kJ·mol-1,请写出辛烷燃烧热的热化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)25。C时,0.1mol/L的HA溶液中c(H+)/c(OH-)=1010.请回答下列问题:
①HA是__________(填“强电解质”或“弱电解质”)。
②在加水稀释HA溶液的过程中,随着水量的增加而增大的是_________(填字母)。
A. c(H+)/c(HA) B. c(HA) /( A-)
C. c(H+)与c(OH-)的乘积 D.c(OH-)
(2)已知:CH4+H2O=CO(g)+3H2(g) 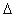 H=+206.2kJ·mol-1
H=+206.2kJ·mol-1
CH4+CO 2=2CO(g)+2H2(g)  H=-247.4kJ·mol-1
H=-247.4kJ·mol-1
CH4(g)与H2O(g)反应生成CO 2(g)和H2(g)的热化学方程式为__________.
(3)下图是利用甲烷燃料电池电解50 mL 2mol/L的氯化铜溶液的装置示意图:
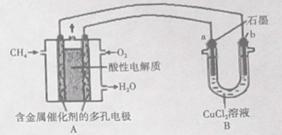
请回答:
①甲烷燃料电池的负极反应式为_______________.
②当线路中有0.6mol电子通过时,B中阳极产物的质量为___________g.
查看答案和解析>>
科目:高中化学 来源: 题型:
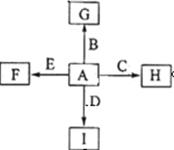
 如图中,A、B、C、D、E是单质,G、H、I、F是B、C、D、E分别和A形成的二元化合物,已知:
如图中,A、B、C、D、E是单质,G、H、I、F是B、C、D、E分别和A形成的二元化合物,已知:
①反应C+G B+H能放出大量的热,G是红综色固体粉末;
②I是一种常见的温室气体,它和E可以发生反应:2E+I 2F+D,F中的E元素的质量分数为60%.
2F+D,F中的E元素的质量分数为60%.
回答问题:
⑴ ①中反应的化学方程式为
(2) 1.6g G 溶于盐酸,得到的溶液与铜粉完全反应,至少需要铜粉 克
(3) C与过量NaOH溶液反应的离子方程式为 ,
反应后的溶液与过量的化合物I反应的离子方程式为
(4) E与I反应的化学方程式为
(5) 写出H物质在工业上的一种用途_____________。
(6)将一定量的B完全溶于过量盐酸中,然后通入0.005mol Cl2,再加入0.01mol重铬酸钾晶体(K2Cr2O7),恰好使溶液中B2+全部转化为B3+,铬元素本身被还原为+3价铬离子。通过计算确定原B的物质的量为( )
A.0.01mol B.0.03mol C.0.04mol D.0.07mol
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述错误的是
A、生铁中含有碳,抗腐蚀能力比纯铁弱 B、用锡焊接的铁质器件,焊接处易生锈
C、在铁制品上镀铜时,镀件为阳极,铜盐为电镀液 D、铁管上镶嵌锌块,铁管不易被腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
下表各选项中,不能利用置换反应通过Y得到W的一组化合物是( )
| 选项化合物 | A | B | C | D |
| Y | CO2 | Fe2O3 | SiO2 | FeCl3 |
| W | MgO | Al2O3 | CO | CuCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
在隔绝空气的条件下,某同学将一块部分被氧化的钠块用一张已除去氧化膜、并用针刺一些小孔的铝箔包好,然后放入盛满水且倒置于水槽中的容器内。待钠块反应完全后,在容器中仅收集到1.12 L氢气(标准状况),此时测得铝箔质量比反应前减少了0.27 g,水槽和容器内溶液的总体积为2.0 L,溶液中NaOH的浓度为0.050 mol·L-1(忽略溶液中离子的水解和溶解的氢气的量)。
(1)写出该实验中发生反应的化学方程式:
;
(2)试通过计算确定该钠块中钠元素的质量分数为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C、D、E是元素周期表中五种短周期元素,原子序数依次增大。 A、B、C、D位于同一周期。已知A原子核外有3个能级,且每个能级上的容纳的电子数目相同。C与E同主族,且C的单质为空气中的主要成份。X元素的原子核外有26个运动状态完全不相同的电子。回答下列问题:
(1)C、D、E中第一电离能最大的是 (填元素符号),X的价电子排布式为
。
(2)B的气态氢化物分子呈 形。该分子的中心原子的杂化方式为 。
 (3)A的一种单质相对分子质量为720,分子构型为一个32面体,
(3)A的一种单质相对分子质量为720,分子构型为一个32面体,
|
种单质中π键的数目为 。
(4)X元素对应的单质在形成晶体时,采用如图2所示
 的堆积方式。则这种堆积模型的配位数为 ,
的堆积方式。则这种堆积模型的配位数为 ,
如果X的原子半径为a cm,阿伏加德常数的值为
NA,则计算此单质的密度表达式为 g/cm3
|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com